
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Задача 19
1. Химико-фармацевтическое предприятие закупило субстанцию сульфацил-натрия для производства глазных капель. Проведение аналитического контроля было поручено студенту-практиканту, проходящему на предприятии производственную практику.
По внешнему виду субстанция представляла собой порошок с выраженным желтоватым оттенком. При растворении в воде наблюдалась опалесценция раствора. рН водного раствора был равен 6,5.
Для установления подлинности использовались реакция с раствором меди сульфата и реакция образования азокрасителя. В результате первой реакции образовался осадок голубого цвета, второй - раствор красного цвета. Количественное определение проводилось методом нитритометрии, содержание сульфацил-натрия составляло 97%.
Проанализируйте полученные результаты и сделайте заключение о качестве сульфацил-натрия.
• Считаете ли правильным выбор данных испытаний для установления подлинности и количественного определения? Если да, то дайте им обоснование и напишите, где возможно, схемы химических реакций.
• Соответствуют ли полученные результаты требованиям нормативной документации? Если нет, то объясните возможные причины несоответствия. Все ли нормативные показатели были определены? Если нет, то предложите дополнительные испытания.
• Какие условия необходимо соблюдать при выполнении количественного анализа? Какие еще реакции для идентификации и методы количественного определения Вы можете предложить?
• Предложите рациональные условия приготовления, стабилизации, упаковки и хранения глазных капель.
2. Предложите рациональную технологию изготовления 30%-го раствора сульфацил-натрия. Обоснуйте механизм стабилизации, объясните особенности упаковки и хранения глазных капель.
3. Обоснуйте требования к стерильным лекарственным формам в соответствии с требованиями GMP. Укажите классы чистоты помещений и технологические приемы, обеспечивающие чистоту помещений.
• Предложите технологическую и аппаратурную схему производства глазных капель.
• Предложите современную упаковку для глазных лекарственных форм. Укажите преимущества и недостатки в сравнении с другими упаковочными материалами.
4. Каков порядок работы с жалобами посетителей аптеки?
• Какая фармацевтическая информация для населения по форме и содержанию входит в обязанности фармацевтических специалистов?
• Какова структура и содержание ФДИ провизора-технолога по приему рецептов и отпуску ЛС?
5. Как проводят хранение лекарственных средств растительного происхождения и лекарственного растительного сырья в аптеках и на складах?
• Приведите примеры сырья различных групп хранения, указав латинские названия, химический состав и применение.
6. В биотехнологическом производстве лекарственных средств большое значение имеет питательная среда.
• Предложите оптимальную питательную среду в биосинтезе антибиотиков.
Ответ
1. Сульфацил-натрий
Sulfacilum natrium

Сульфацетамид натрия
n-аминобензолсульфонилацетамид-натрий моногидрат
Относится к группе сульфаниламидных препаратов, это производное n-аминобензолсульфамида.
Фармакологическое действие сульфаниламидов обусловлено наличием в молекуле лекарственного вещества амида сульфаниловой кислоты. Сульфацил-натрий обладает, как и все сульфаниламиды, химиотерапевтической активностью при инфекциях, вызванных грамположительными и грамотрицательными бактериями.
Хорошая растворимость в воде позволяет использовать сульфацил-натрий для инъекций при пневмониях, гнойных трахеобронхитах, инфекциях мочеполовых путей. Назначают в глазной практике в виде 20-30% растворов и мазей.
Сульфацил-натрий – белый кристаллический порошок без запаха. Как и другие натриевые соли, легко растворим в в оде и метаноле, и практически нерастворим в органических растворителях (этаноле, эфире, хлороформе, ацетоне).
Сульфацил-натрий можно идентифицировать по характеру УФ-спектров.
2. Для идентификации используют общие и частные реакции, обусловленные физико-химическими свойствами, растворимостью и наличием функциональных групп в молекуле: первичной ароматической аминогруппы, ароматического цикла, сульфамидной группы, ацетильной группы.
Общие реакции:
Реакция образования азокрасителя (на первичную ароматическую аминогруппу) основана на образовании хлорида диазония при действии раствором нитрита натрия и разведенной хлороводородной кислотой. Последующее сочетание хлорида диазония с фенолами в щелочной среде приводит к образованию азокрасителя:

вишнево-красное окрашивание
или осадок оранжево-красного цвета
 Лигниновая проба. Это своеобразная разновидность реакции образования шиффовых оснований. Она выполняется на древесине или газетной бумаге, при нанесении на которую сульфацила-натрия и капли разведенной соляной кислоты появляется оранжево-желтое окрашивание. Сущность происходящего химического процесса в том, что образуются ароматические альдегиды. Альдегиды взаимодействуют с первичными ароматическими аминами, образуя шиффовы основания:
Лигниновая проба. Это своеобразная разновидность реакции образования шиффовых оснований. Она выполняется на древесине или газетной бумаге, при нанесении на которую сульфацила-натрия и капли разведенной соляной кислоты появляется оранжево-желтое окрашивание. Сущность происходящего химического процесса в том, что образуются ароматические альдегиды. Альдегиды взаимодействуют с первичными ароматическими аминами, образуя шиффовы основания:
Реакция галогенирования (на ароматический цикл). Эта реакция основана на наличии донорной группы в ароматическом ядре молекулы сульфацила-натрия (заместитель первого рода):
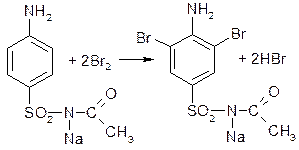
Реакция обнаружения серы (в сульфамидной группе). Наличие серы в молекуле сульфацила-натрия можно установить после окисления органической части молекулы концентрированной азотной кислотой или сплавления с 10-кратным количеством нитрата калия до сульфат-иона. Последний затем обнаруживают с помощью раствора хлорида бария:
SO42- + BaCl2 → BaSO4↓ + 2Cl-
Гидролиз. При термическом разложении сульфацила-натрия в сухой пробирке образуется плав и ощущается запах уксусной кислоты.
Реакция с растворами солей тяжелых металлов. Ионы меди, замещая подвижный атом водорода сульфамидной группы, образуют с сульфацилом-натрия внутрикомплексное соединение голубовато-зеленоватого цвета, не изменяющегося при стоянии:
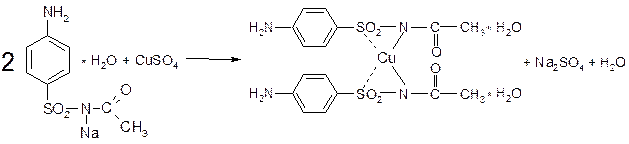
Реакция с нитропруссидом натрия. Раствор сульфацила-натрия в присутствии едкой щелочи образует окрашеный в красный цвет раствор.
Частная реакция на сульфацил-нария:
Сульфацил-натрий при действии уксусной кислотой выделяет белый осадок сульфацила, который после высушивания должен иметь температуру плавления около 183ºС:

При растворении осадка в этаноле и добавлении концентрированной серной кислоты образуется этилацетат, имеющий характерный запах:
 |
Катион натрия можно обнаружить по окраске бесцветного пламени в желтый цвет.
Количественное определение сульфацила-натрия можно провести с помощью физико-химических методов анализа.
Используют УФ- и ИК-спектроскопию, фотоколориметрию.
ИК-спектр сульфацила-натрия в таблетке калия бромида снимают в области от 400 до 4000 см-1.
УФ-спектр сульфацила-натрия имеет максимум светопоглощения при 256 нм. Содержание рассчитывают по раствору стандартного образца.
Фотоколориметрический метод основан на измерении оптической плотности окрашенных продуктов реакции (с нитропруссидом натрия, реакции образования азокрасителя).
Широко используют для количественного определения сульфацила-натрия нитритометрию. Титрант – 0,1 М раствор нитрита натрия. Определение ведут в кислой среде при температуре + 4ºС в присутствии бромида калия. Точку эквивалентности устанавливают по внутреннему индикатору – нейтральному красному, по внешнему индикатору – иодкрахмальной бумаге или потенциометрически.

Внешний индикатор при нитритометрическом титровании используют в тех случаях, когда образуется окрашенная соль диазония, маскирующая переход окраски внутреннего индикатора. Титрование с иодкрахмальной бумагой ведут до тех пор, пока капля титруемого раствора, взятая через 1 минуту после прибавления титранта, не вызовет тотчас же посинение бумаги:
2KI + 2NaNO2 + 4HCl → I2 + 2NO↑ + 2NaCl + 2KCl + 2H2O
Натриевые соли сульфаниламидных препаратов титруют кислотой в спирто-ацетоновой среде (индикатор – метиловый оранжевый):

Метод броматометрического определения основан на галогенировании сульфаниламидов. Титруют раствором бромата калия в кислой среде в присутствии калия бромида. Конец титрования устанавливают по обесцвечиванию индикатора метилового оранжевого выделяющимся бромом, или иодометрически:
KBrO3 + 5KBr + 6HCl → 3Br2 + 6KCl + 3H2O
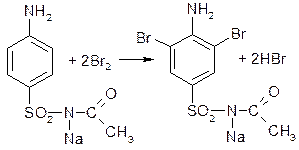
Br2 + 2KI → I2 + 2KBr
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
3. Сульфацил-натрий при неправильном хранении постепенно теряет воду, что может привести к изменению его физических свойств. Под действием света, кислорода воздуха и воды в процессе хранения его происходит разложение. Чаще всего оно сопровождается реакцией гидролиза с образованием сульфаниловой кислоты и других веществ, которые затем окисляются. Поэтому некоторые сульфаниламиды темнеют, а их растворы желтеют.
 |
| <== предыдущая страница | | | следующая страница ==> |
| Задача 18 | | | Задача 20 |
Дата добавления: 2015-06-30; просмотров: 1969; Нарушение авторских прав

Мы поможем в написании ваших работ!