
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Теоретическая часть. Хром представляет собой твердый блестящий металл, плавящийся при 1890 ˚С; плотность его 7,19 г/см3
Хром представляет собой твердый блестящий металл, плавящийся при 1890 ˚С; плотность его 7,19 г/см3. У него достраивается d - подуровень предпоследнего слоя. В силу стабильности конфигурации d5 у атомов хрома и молибдена наблюдается проскок одного электрона с оболочки ns на оболочку (n-1)d. У атомов хрома валентная электронная конфигурация 3d54s1. Внешняя электронная оболочка содержит один электрон, что обусловливает металлический характер этого элемента. Максимальная степень окисления равна +6, так как, помимо наружных электронов, в образовании связей может участвовать еще соответствующее число электронов из недостроенной предпоследней оболочки. Для хрома также характерны степени окисления +2,+3.
Соединения хрома (VI) отличаются неустойчивостью в растворах и являются сильными окислителями. При этом они чаще всего восстанавливаются до анионных или катионных комплексов хрома (III). Наиболее устойчивой степенью окисления хрома является +3. Это связано с тем, что соединения хрома (III) являются, как правило, комплексными с координационным числом 6 и октаэдрической пространственной конфигурацией расположения лигандов.
При комнатной температуре хром стоек к воде и к кислороду воздуха. Поверхность его покрывается оксидной пленкой, препятствующей коррозии.
Хром образует три оксида: оксид хрома (II) CrO, имеющий основной характер, оксид хрома (III) Cr2O3, проявляющий амфотерные свойства, и оксид хрома (VI) CrO3– кислотный оксид.
В водных растворах соли хрома гидратированы и содержат комплексный катион [Cr(H2O)6]3+, который обусловливает фиолетовую окраску. При нагревании растворов соли хрома CrCl3*6H2O часть координационной воды обменивается на хлорид-ионы (гидратная изомерия):
[Сr(Н2О)]6Cl3 ↔ [СrС1(Н2O)5]Cl2*Н2О ↔ [СrС12(Н2O)4]С1*2Н2О
фиолетовый зеленый темно-зеленый
Н2СrО4 - xромовая кислота, образующая соли хроматы. Н2Сr2О7 - двухромовая кислота, ее соли - дихроматы. Как хромовая, так и двухромовая кислоты неустойчивы, однако их соли более прочны. В водных растворах хромат- и дихромат–ионы образуют равновесную систему:
Сr2O72− + Н2О ↔ 2СrO42− + 2Н+
Отсюда следует, что в кислой среде равновесие смещено влево, в результате хромат превращается в дихромат, а при разбавлении водой или в щелочной среде – вправо и в результате дихромат переходит в хромат. Переход хромата в дихромат и наоборот можно наблюдать по изменению цвета окраски раствора.
Хроматы и дихроматы – сильные окислители, особенно в кислой среде.
Марганец, технеций и рений входят в VII-В подгруппу периодической системы и завершают первые пятерки вставных декад d-элементов. Их валентная электронная конфигурация (n-1)d5ns2. Имея на внешней электронной оболочке атома всего два электрона, марганец и его аналоги не способны присоединять электроны и в отличие от галогенов, соединений с водородом не образуют. Высшая степень окисления у них равна +7.
Для марганца наиболее характерны степени окисления +2 , +4, +7, относительно легко получаются производные, отвечающие степеням окисления 0, +3, +5, +6. Относительно стабильна степень окисления +2, поскольку наполовину заполненная d-оболочка отличается повышенной устойчивостью.
Марганец – серебристо-белый твердый хрупкий металл. Его плотность 7,44 г/см3, температура плавления 1245 ˚С.
В ряду напряжений марганец находится между алюминием и цинком: стандартный электродный потенциал Mn/Mn2+= − 1,18 В. На воздухе марганец покрывается тонкой защитной оксидной пленкой, предохраняющей его от дальнейшего окисления даже при нагревании. Но в мелкораздробленном состоянии марганец окисляется довольно легко. Вода при комнатной температуре действует на марганец очень медленно, при нагревании – быстрее. Марганец вытесняет водород из разбавленных кислот. Однако концентрированную серную кислоту он восстанавливает до оксида серы (IV), а азотную - до оксида азота (II); при этом образуются катионы Mn2+.
Марганец образует четыре простых оксида: MnO, Мn2O3, обладающие основными свойствами, MnO2- амфотерный, Мn2O7- ангидрид марганцовой кислоты НMnO4.
Оксид марганца МnО нерастворим в воде, поэтому гидроксид марганца (II) получают действием щелочей на соли двухвалентного марганца, выпадает белый осадок гидроксида марганца. На воздухе гидроксид марганца (II) быстро темнеет, окисляясь в бурый гидроксид марганца (IV).
В практическом отношении наиболее важны соединения маргнца (II), диоксид марганца и соли марганцовой кислоты- перманганаты.
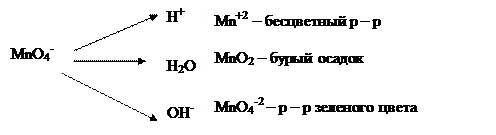
Перманганаты – сильные окислители. Степень окисления марганца в реакциях изменяется в зависимости от pН-среды:
 |
| <== предыдущая страница | | | следующая страница ==> |
| Опыт 4 Окислительные свойства железа (III) | | | Опыт 7 Окислительные свойства соединений марганца (VII). Влияние рН-среды на характер восстановления перманганат-иона |
Дата добавления: 2015-07-26; просмотров: 274; Нарушение авторских прав

Мы поможем в написании ваших работ!