
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Определение химических формул соединений
Химическая формула соединения показывает качественный (из атомов каких элементов состоит данное вещество) и количественный состав (число атомов каждого элемента, входящее в состав молекулы, или количество атомов элементов, входящее в состав 1 моль вещества). Различают простейшие и молекулярные (истинные) формулы.
Простейшая формула показывает наименьшее соотношение чисел атомов элементов в веществе. Количественное соотношение атомов в веществе часто выражают в виде массовых долей элементов.
Молекулярная формула дает представление об истинном количественном составе молекулы. Для ее определения необходимо знать относительную молекулярную или молярную массы вещества.
В научно-исследовательских лабораториях при получении и исследовании новых веществ их формулы выводят на основе полученных качественных и количественных показателей состава. У исследуемого вещества определяют процентное содержание (массовую долю) элементов и величину, позволяющую вычислить молярную массу соединения (относительную или абсолютную плотность, массу определенного объема при нормальных или других условиях).
Массовые доли элементов в веществе вычисляют по формуле:
 , или
, или 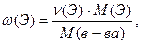 (1); (1а)
(1); (1а)
где n(Э) – число атомов элемента в молекуле,
ν(Э) – количество элемента в 1 моль вещества.
Пользуясь формулой (1), можно определить число атомов каждого элемента в молекуле, а по формуле (1а) – количества элементов в 1 моль вещества:
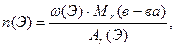
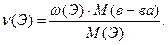 (2); (2а)
(2); (2а)
В ряде текстов задач по выводу формул соединений отсутствуют данные, необходимые для расчета молярной массы. В этом случае возможно определить лишь простейшую формулу, т.е. найти отношение количеств элементов.
В текстах задач по выводу простейших формул указываются либо массовые доли элементов в процентах, либо массы элементов в данной массе вещества, либо их отношение. Так как массовая доля элемента в процентах показывает, какая масса элемента содержится в 100 г вещества, количество элемента в 100 г можно найти по формуле:
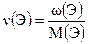
Пример 1. В состав древесной золы входит вещество, называемое поташом. Выведите его формулу, если оно содержит 56,6% калия, 8,7% углерода и 34,8% кислорода.
Решение
| w(К) = 56,6% w(С) = 8,7% w(О) = 34,8% | 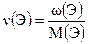
| n(К) : n(С) : n(О) =  = 1,45 : 0,72 : 2,17 = = 2 : 1 : 3
Ответ: формула поташа К2СО3. = 1,45 : 0,72 : 2,17 = = 2 : 1 : 3
Ответ: формула поташа К2СО3.
|
| Формула – ? | ||
| М(К) = 39 г/моль М(С) = 12 г/моль М(О) = 16 г/моль |
Пример 2. Выведите простейшую формулу вещества, состоящего из магния, серы и кислорода в массовом отношении 3 : 4 : 8.
Решение
| m(Mg) : m(S) : m(O) = 3 : 4 : 8 | 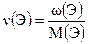
| n(Mg) : n(S) : n(О) = 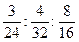 = 0,125 : 0,125 : : 0,5 = 1 : 1 : 4
Ответ: формула MgSО4. = 0,125 : 0,125 : : 0,5 = 1 : 1 : 4
Ответ: формула MgSО4.
|
| Формула – ? | ||
| М(Mg) = 24 г/моль М(S) = 32 г/моль М(О) = 16 г/моль |
В задачах часто молекулярная (или молярная) масса вещества не дается, а указываются величины, позволяющие их вычислить.
Молярную массу вещества можно определить по относительной плотности. Например:
М(в-ва) = 2 × 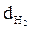 (в-ва), тогда n(Э) =
(в-ва), тогда n(Э) = 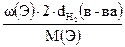 .
.
Пример 3. Органическое вещество содержит 84,21% углерода и 15,79% водорода. Плотность его паров по воздуху составляет 3,93. Определите формулу этого соединения.
Решение
| w(С) = 84,21% w(Н) = 15,79% dв = 3,93 | n(Э) = 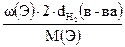 ;
М(в-ва) = 29 × dв(в-ва);
n(Э) = ;
М(в-ва) = 29 × dв(в-ва);
n(Э) = 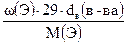
| n(С) = 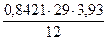 = 8 (моль)
n(Н) = = 8 (моль)
n(Н) =  = 18 (моль)
Ответ: формула С8Н18. = 18 (моль)
Ответ: формула С8Н18.
|
| Формула – ? | ||
| М(С) = 12 г/моль М(Н) = 1 г/моль |
В задачах может быть указана абсолютная плотность газа. Тогда вычисляют молярную массу газа как произведение плотности и молярного объема:
М(в-ва) = r(в-ва) × Vm(в-ва); n(Э) = 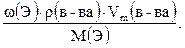
Пример 4. Определяя состав вещества в лаборатории, установили, что в нем содержится 52,18% углерода, 13,04% водорода и 34,78% кислорода. Плотность паров неизвестного вещества 2,05 г/л. Какова его формула?
Решение
| w(С) = 52,18% w(Н) = 13,04% w(О) = 34,78% r(в-ва) = 2,05 г/л | n(Э) =  ;
М(в-ва) = r(в-ва) × Vm(в-ва);
n(Э) = ;
М(в-ва) = r(в-ва) × Vm(в-ва);
n(Э) = 
| n(С) =  = 2 (моль)
n(Н) = = 2 (моль)
n(Н) =  = 5,99 » 6 (моль)
n(О) = = 5,99 » 6 (моль)
n(О) =  = 0,99 » 1 (моль)
Ответ: формула С2Н6О. = 0,99 » 1 (моль)
Ответ: формула С2Н6О.
|
| Формула – ? М(С) = 12 г/моль М(Н) = 1 г/моль М(О) = 16 г/моль Vm(газа) = 22,4 л/моль |
В более усложненных задачах для вычисления молярной массы в условии указывается масса определенного объема газа при н.у. Из курса физики вам известно, что:
r(в-ва) = 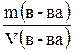 ; значит М(в-ва) =
; значит М(в-ва) = 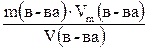 .
.
Подставляя это выражение в формулу (2а), получим уравнение, позволяющее рассчитать количество каждого элемента в веществе:
n(Э) = 
Пример 5. Масса неизвестного газа объемом 200 мл (н.у.) равна 0,232 г. Какова формула этого вещества, если в его состав входит 92,3% углерода и 7,7% водорода?
Решение
| w(С) = 92,3% w(Н) = 7,7% m(газа) = 0,232 г V(газа) = 200 мл | М(в-ва) = r(в-ва) × Vm(в-ва)
r(в-ва) =  М(в-ва) =
М(в-ва) =  n(Э) =
n(Э) = 
| n(С) = 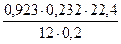 = 2 (моль)
n(Н) = = 2 (моль)
n(Н) = 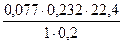 = 2 (моль)
Ответ: формула С2Н2. = 2 (моль)
Ответ: формула С2Н2.
|
| Формула – ? | ||
| М(С) = 12 г/моль М(Н) = 1 г/моль Vm(газа) = 22,4 л/моль |
В олимпиадных задачах часто объем данной массы газа указывается при определенной температуре и давлении. В этом случае молярная масса вычисляется по уравнению Менделеева – Клапейрона:
pV = 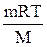 , откуда М =
, откуда М =  . И n(Э) =
. И n(Э) =  .
.
Пример 6. В лаборатории в приборе для определения относительных молекулярных масс испарили 0,5532 г полученного вещества, пары которого вытеснили 287 мл воздуха, измеренного при 14оС и 100 кПа. Вещество состояло из 52,17% углерода, 13,04% водорода и 34,78% кислорода. Какое вещество исследовали в лаборатории?
Решение
| w(С) = 52,17% w(Н) = 13,04% w(О) = 34,78% m(в-ва) = 0,5532 г V(газа) = 287 мл tо = 14оС р = 100 кПа | pV =  М =
М = 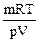 n(Э) =
n(Э) = 
| n(С) = 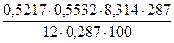 = 2 (моль)
n(Н) = = 2 (моль)
n(Н) = 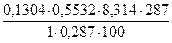 = 6 (моль)
n(О) = = 6 (моль)
n(О) = 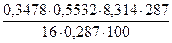 = 1 (моль)
Ответ: формула С2Н6О. = 1 (моль)
Ответ: формула С2Н6О.
|
| Формула – ? | ||
| М(С) = 12 г/моль М(Н) = 1 г/моль М(О) = 16 г/моль R = 8,314 ж/(моль×К) |
В некоторых задачах на вывод формул даны только относительная молекулярная или молярная массы или величины, позволяющие их рассчитать. В этом случае для определения формулы нужно знать, к какому классу веществ принадлежит данное соединение.
Пример 7. Какова формула алкана, относительная плотность которого по воздуху равна 2,48?
Решение
| Алкан dв(алкана) = 2,48 | Алканы имеют общую формулу СnH2n+2. Молярную массу алкана можно рассчитать по этой формуле и по относительной плотности. Очевидно, что молярные массы, рассчитанные этими способами, равны друг другу. Исходя из этого, можно составить алгебраическое уравнение: М(СnН2n+2) = 12n + 2n + 2 = 14n + 2; М(СnН2n+2) = 29×2,48 = 72 (г/моль). 14n + 2 = 72, откуда n = 5 Ответ: формула С5Н12. |
| Формула – ? | |
М(С) = 12 г/моль
М(Н) = 1 г/моль
 (воздуха) = 29 г/моль (воздуха) = 29 г/моль
|
Пример 8. Определите молекулярную формулу углеводорода, имеющего плотность по азоту 2,071.
Решение
Углеводород
 (углеводорода) = 2,071 (углеводорода) = 2,071
| М(углеводорода) = 28×2,071 = 57,988 » 58 (г/моль). Предположим, что соединение имеет формулу СхНу, тогда подставив значения молярных масс, получим: 12х + у = 58. Общие формулы: –алканов – СnН2n+2 – алкенов – СnН2n – алкинов - СnН2n-2 Значит, у £ 2х + 2. |
| Формула – ? | |
| М(С) = 12 г/моль М(Н) = 1 г/моль М(N2) = 28 г/моль | |
| Тогда 58 – 12х £ 2х + 2, откуда х ³ 4. Если х > 4, то есть 5, то неравенство примет вид: (60 + у) > 58, что не соответствует уравнению 12х + у = 58. Значит х = 4, а у = 10. Ответ: формула углеводорода С4Н10. |
Часто можно столкнуться с задачами на определение молекулярной формулы вещества по результатам его химических превращений, в частности, по продуктам сгорания.
При этом находят количества элементов, входящих в состав вещества, в продуктах реакции, а затем – отношение этих количеств.
Пример 9. При сжигании 0,29 г газообразного вещества получили 448 мл углекислого газа (н.у.) и 0,45 г паров воды. Плотность вещества по водороду равна 29. Определите молекулярную формулу вещества.
Решение
m(в-ва) = 0,29 г
V(СО2) = 448 мл
m(Н2О) = 0,45 г
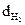 (в-ва) = 29 (в-ва) = 29
| М = 2 × 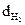
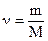
| М(в-ва) = 2 × 29 = 58 (г/моль) n(в-ва) = 0,29 : 58 = 0,005 (моль) n(СО2) = n(С) = 0,448 : 22,4 = 0,02 (моль) n(Н) = 2n(Н2О) = 2 × (0,45 : 18) = 0,05 (моль) m(С) = 12 × 0,02 = 0,24 (г) m(Н) = 1 × 0,05 = 0,05 (г) m(С) + m(Н) = 0,24 + 0,05 = 0,29 (г) = m(в-ва) Значит, вещество – углеводород. n(С) : n(Н) = 0,02 : 0,05 = 2 : 5, значит простейшая формула С2Н5, а истинная – (С2Н5)n 29n = 58, откуда n = 2. Ответ: формула вещества С4Н10. |
| Формула – ? | ||
| М(Н2О) = 18 г/моль М(Н2) = 2 г/моль Vm(газа) = 22,4 л/моль |
Для решения задач на вывод формул по результатам химических превращений иногда можно использовать закон объемных отношений Гей-Люссака (если в реакции участвуют газы) и закон сохранения массы.
Пример 10. Для полного сжигания 1 л неизвестного газа потребовалось 2 л кислорода. В результате реакции получилось 1 л азота и 2 л углекислого газа. Определите формулу сгоревшего вещества.
Решение
| V(в-ва) = 1 л V(О2) = 2 л V(N2) = 1 л V(СО2) = 2 л | По закону объемных отношений: n(в-ва) : n(О2) : n(N2) : n(СО2) = V(в-ва) : V(О2) : V(N2) : V(СО2) = = 1 : 2 : 1 : 2. На этой основе составляем схему реакции: В-во + 2 О2 ® N2 + 2 СО2. По закону сохранения массы определяем, что в состав неизвестного вещества входят углерод и азот. Кислорода в нем нет, т. к. весь кислород, вступивший в реакцию, вошел в состав углекислого газа. Из схемы реакции видно, что в состав 1 моль вещества входят 2 моль азота и 2 моль углерода. Ответ: формула сгоревшего вещества С2N2. |
| Формула – ? | |
Задачи на вывод формул веществ по результатам химических превращений могут быть самыми разнообразными.
| <== предыдущая страница | | | следующая страница ==> |
| Взаимное влияние атомов в молекулах производных бензола | | | Цепочки превращений |
Дата добавления: 2015-07-26; просмотров: 644; Нарушение авторских прав

Мы поможем в написании ваших работ!