
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
РАСТВОРОВ. АКТИВНОСТЬ
ТЕРМОДИНАМИКА КОНЦЕНТРИРОВАННЫХ
Активность можно определить как величину, характерную для реального раствора, которую подставляют вместо концентрации в уравнение для химического потенциала идеального раствора.
mI = mi0 + RTln ai
Активность называется эффективной или действующей концентрацией. Ввел это понятие Льюис.
Рассмотрим химический потенциал компонента в растворе и насыщенном паре над этим раствором.
В растворе
mi = mi0 + RTln ai
в паре
mi = mi0n + RTln Pi
для чистого компонента в паре
mi0 = mi0n + RTlnPi 0
компонуя уравнения получим
ai = 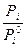
т.е. активность компонента равна отношению давления его пара над раствором к давлению пара над чистым раствором более строго
ai = 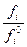
Важной характеристикой раствора является коэффициент активности.
Для идеального раствора
mИД = mi0 + RTln Ni
для реального раствора
mi = mi0 + RTln ai
mI - mид = RTln 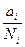
g = 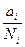 - коэффициент активности.
- коэффициент активности.
Коэффициент активности характеризует работу или изменение химического потенциала при переходе компонента из идеального раствора в реальный.
Очень важен вопрос о выборе стандартного состояния. Для растворов часто принимают стандартным такое состояние, чтобы для предельно разбавленных растворов g = 1.
В том случае, когда активность определяется через мольные доли коэффициент активности называется рациональным. Если концентрация выражается в молях на литр, то коэффициент активности называется практическим.
| <== предыдущая страница | | | следующая страница ==> |
| | | РАСТВОРИМОСТЬ ГАЗОВ В ЖИДКОСТЯХ. ЗАКОН ГЕНРИ |
Дата добавления: 2014-03-11; просмотров: 422; Нарушение авторских прав

Мы поможем в написании ваших работ!