
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
КОВАЛЕНТНАЯ СВЯЗЬ
Метод МО есть распространенный на молекулы метод атомных орбиталей. Предполагается, что электроны в молекуле находятся на орбиталях, охватывающих все ядра в молекуле.
Для построения волновой функции основного состояния молекулы распределяют все ее электроны по МО с наименьшей энергией по вариационному методу, учитывая ограничения, налагаемые принципом Паули, согласно которому на одной орбитали не может находиться больше двух электронов.
Чаще всего в методе МО применяют приближение ЛКАО для построения МО. Вблизи ядра электроны находятся в поле потенциала, создаваемого в основном этим ядром. Поле, обусловленное другими ядрами, в этой области сравнительно мало. Поэтому, вблизи ядра МО должна быть близка к АО соответствующего атома. Учитывая это, предполагают, что разумное приближение к МО во всех точках пространства можно получить, беря линейную комбинацию атомных орбиталей, относящихся ко всем атомам в молекуле.
y = åciji
y -МО
j -АО
сi- коэффициенты
Если в это разложение включить достаточно большое число АО,
то, вычисляя коэффициенты на основе вариационного принципа, можно получить хорошее приближение к истинной МО.
Рассмотрим сущность вариационного метода.
Уравнение Шредингера
Нy=Еy
Е- полная энергия молекулы
Умножив обе части на ydt и проинтегрировав получим
E = 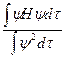
Если волновая функция является одним из решений волнового уравнения, то расчет по этой формуле дает значение дозволенного уровня энергии электрона Е, dt - элемент объема пространства. Если представить искомую волновую функцию в виде
y1 = c1j1 + c2j2 + ¼+cnjn
то выражение может быть записано
 e =
e = 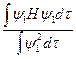
где e меняется в зависимости от выбора y и называется энергетической функцией.
Ввариационном методе исходят из того,что чем меньше энергетическая функция ,тем она ближе к действительному значению энергии основного состояния, а выбранная функция к истинной. Очевидно, что при подстановке уравнение величина энергетической функции будет зависеть от коэффициентов с1,.с2, cn .
Согласно вариационному методу эти коэффициенты нужно выбирать так, чтобы значения энергетической функции были минимальными. Это удобно делать, рассматривая коэффициенты как переменные величины. Тогда условия минимума выразятся системой уравнений
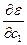 = 0
= 0 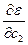 = 0 ………
= 0 ………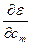 = 0
= 0
Решение системы уравнений позволяет найти значения с1,с2,сn, при которых энергетическая функция минимальна.
В качестве примера рассмотрим простейшую молекулярную частицу - молекулярный ион водорода Н2+.
Согласно метода ЛКАО молекулярную орбиталь можно представить в виде y = с1 jа + с2 jв
где а и в - обозначения ядер
Поскольку атомы неразличимы, то плотность вероятности нахождения электрона около каждого из ядер должна быть одной и той же. Это выполняется в случае
с12 = с22
с1 = с2 yg = Сg ( ja+ jb )
с1 = -с2 yu = Сu ( ja - jb )
yg - симметричная волновая функция
yu - антисимметричная волновая функция
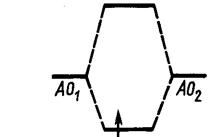
Симметричная функция отражает увеличение плотности электронного облака в области перекрывания между двумя атомами по сравнению с плотностью облаков отдельных атомов.
Увеличение плотности отрицательно заряженного электронного облака между положительными ядрами приводит к тому, что ядра как бы стягиваются этим облаком и возникает химическая связь.
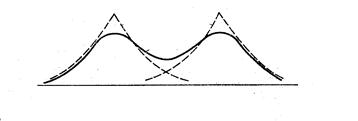
Система электрон в поле двух протонов находится в энергетически более выгодном состоянии Е ,чем исходная система электрон в поле одного протона
Eg
Поэтому yg называется связывающей молекулярной орбиталью.
Антисимметричной волновой функции отвечает уменьшение плотности электронного облака между атомами. При этом полoжительно заряженные атомы отталкиваются и система становится неустойчивой.
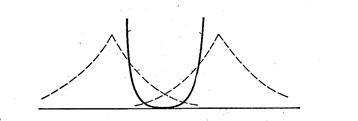
Молекулярной орбитали отвечает энергия большая, чем энергия атома водорода
Eu
Eg
Орбиталь yu ,соответствующая повышению энергии, называется
разрыхляющей МО.
| <== предыдущая страница | | | следующая страница ==> |
| ИОННАЯ СВЯЗЬ. ЭНЕРГИЯ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ | | | РАСЧЕТ МОЛЕКУЛЯРНОГО ИОНА ВОДОРОДА |
Дата добавления: 2014-03-11; просмотров: 435; Нарушение авторских прав

Мы поможем в написании ваших работ!