
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
РАСЧЕТ МОЛЕКУЛЯРНОГО ИОНА ВОДОРОДА
e = 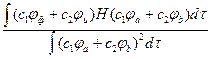
e[c12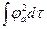 + c22
+ c22 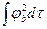 + 2c1c2
+ 2c1c2 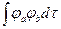 ] = c12
] = c12 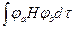 + c22
+ c22
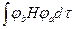 + c1c2
+ c1c2 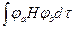 + с1с2
+ с1с2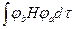
S = Sab = Sba = 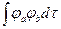 интеграл перекрывания
интеграл перекрывания
Hab = Hba =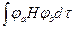 =
=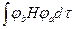 - резонансный или обменный
- резонансный или обменный
интеграл
Нaa = Hbb = 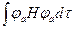 =
= 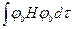 - кулоновский интеграл
- кулоновский интеграл
Интеграл перекрывания отражает степень перекрывания двух
АО jа и jb.
Кулоновский интеграл равен энергии одного электрона, принадлежащего данному атому -отрицательная величина.
Резонансный интеграл - характеризует взаимодействие электронных орбиталей соседних атомов в молекуле ( энергия электронного заряда, распределенного с плотностью перекрывания в поле притяжения обоих ядер - отрицательная величина)
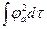 =
= 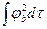 = 1
= 1
e ( c12 + c22 + 2c1 c2 S ) = ( c12 + c22 ) Haa + 2c1 c2 Hab
Используя вариационный метод находим производные
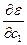
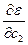
и приравниваем их нулю.
2 с1 e + 2 c2 e S = 2 c1 Haa + 2 c2 Hab
c1 ( Haa - e ) + c2 ( Hab - e S ) = 0
2 c2 e + 2 c1 e S = 2 c2 Haa + 2 c1 Hab
c1(Hab - e S ) + c2 ( Haa - e ) = 0
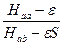 = w
= w
c1w + c2 = 0
c1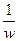 + c2 = 0
+ c2 = 0
отсюда w = 1/v
v2 = 1
v = -1 v = 1
Подставив эти выражения в формулу получим энергии двух молекулярных орбиталей
Haa - E = Hab - E S
Haa - E = - Hab + E S
Eu = 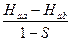
Eg = 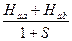
В связи с тем, что величина резонансного интеграла < 0, энергия Еg < Eu
Подставляя значения в другое уравнение получим
с1 =с2 с1 = - с2
Возьмем условия нормировки
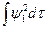 =
=  (c1 ja+c2 jb)2 dt= c1`2 + c22 + 2c1c2 S=1
(c1 ja+c2 jb)2 dt= c1`2 + c22 + 2c1c2 S=1
Отсюда получим
Cg = C1 = C2 = 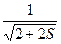
Cu = C1 = - C2 =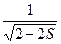
Подставляя эти значения получим выражение для МО
yg = 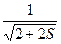 (ja + jb)
(ja + jb)
yu = 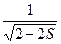 (ja - jb)
(ja - jb)
Таким образом, при расчете по методу МО получаются два уровня энергии системы и соответственно две орбитали: связывающая, отвечающая образованию химической связи и разрыхляющая, характеризующая отталкивание.
| <== предыдущая страница | | | следующая страница ==> |
| МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ | | | ТЕОРИЯ ВАЛЕНТНЫХ СВЯЗЕЙ |
Дата добавления: 2014-03-11; просмотров: 335; Нарушение авторских прав

Мы поможем в написании ваших работ!