
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ЦЕПНЫЕ РЕАКЦИИ
Химические процессы, протекающие через ряд регулярно повторяющихся элементарных реакций с участием радикалов, атомов или ионов, называются цепными реакциями. По цепному механизму протекают процессы горения, многие фотохимические реакции, некоторые реакции полимеризации и конденсации при получении полимеров. По цепному механизму происходит распад ядер урана и плутония в атомных реакторах. Во всякой цепной реакции можно выделить три стадии: 1) зарождение цепи, 2) развитие цепи, 3) обрыв цепи. Зарождение цепи начинается с элементарного химического акта, в результате которого в системе появляются частицы со «свободными валентностями» - радикалы, атомы или ионы. Частицы со свободными валентностями могут появляться в результате термического распада отдельных молекул на атомы или радикалы. Радикальные частицы на ВЗМО имеют по одному электрону и отличаются высокой реакционной способностью. Например, в смеси Н2 и Br2 в газообразном состоянии молекулы Вг2 могут частично диссоциировать на атомы Вг2 ® 2Вг*. Атомарный Вг* - радикальная частица, может быть инициатором цепной реакции.
Радикальные частицы могут появляться при столкновении молекул со стенками сосуда
Cl2 + стенка ® С1* + С1адс,
а также в результате бимолекулярного элементарного акта. Например, при повышенной температуре в смеси Н2 и О2могут протекать следующие реакции с образованием радикалов:
Н2 + О2 ® 2ОН* и Н2 + О2 ® Н + НО2*.
Частицы со свободной валентностью могут образовываться в результате освещения системы. Так, например, Сl2 при освещении солнечным светом поглощает квант энергии и распадается на атомы:
Cl2 + 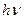 ® Cl2* ® 2Cl.
® Cl2* ® 2Cl.
Часто для зарождения цепной реакции в систему вводят вещества так называемые инициаторы, которые легко распадаются в растворе или в газовой фазе на атомы и радикалы.
По особенностям стадии развития цепи цепные реакции делятся на две группы: неразветвленные цепные реакции, когда в процессе развития цепи число свободных валентностей в звене цепи остается постоянным, и разветвленные цепные реакции, когда развитие цели идет с увеличением свободных валентностей в звене цепи. В качестве примера неразветвленной цепной реакции рассмотрим реакцию взаимодействия водорода с хлором. В темноте водород и хлор практически не взаимодействуют. Но при освещении системы солнечным светом реакция протекает со взрывом. Зарождение цепи происходит при поглощении молекулой С12 кванта энергии hn:
Cl2 + hn ® 2Сl*.
Скорость зарождения цепи пропорциональна концентрации С12:
v = k0CCl2.
Константа скорости реакции зависит от интенсивности освещения. Далее начинается цепная реакция
Сl* + Н2 ® HCl + H* ; v1 = k1CCl*CH2;
Н* + С12 ® НС1 + Сl* ; v2 = k2CH*CCl2;
Cl* + H2 ® HCl + H* и т.д.
Суммарную реакцию в звене цепи можно выразить в форме
Н2 + С12 ® 2НС1.
В результате химических реакций, составляющих звено неразветвленной химической реакции, число радикалов в системе не увеличивается. Цепная реакция продолжается, пока не исчезнут частицы со свободными валентностями. Число звеньев в цепи определяет длину цепи. Длина цепи в реакции взаимодействия Н2 и Сl2 доходит до нескольких сот тысяч звеньев.
Средняя длина цепи n может быть определена из соотношения
n = v/v0,
где v - скорость образования продуктов реакции; v0 - скорость зарождения цепи.
Обрыв цепи происходит в результате столкновения радикальных частиц со стенками сосуда, например:
Сl* + стенка ® Сlадс ; v3 = k3 ScCl*;
Н* + стенка ® Надс ; v4 = k4SH*;
или в результате тройного столкновения типа:
Cl* + Cl* + M ® Cl2 + M ; v5 = k5cMc2 Cl*;
H* + H* + M ® H2 + M ; v6 = k6cMcH2;
H* + Cl* + M ® HCl + M ; v7 = k7cMcH*cCl*,
где М - одна из молекул газовой системы.
Общая скорость цепной реакции определяется скоростью образования НС1:
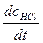 = v1 + v2 = k1cCl*cH2 + k2cH*cCl2.
= v1 + v2 = k1cCl*cH2 + k2cH*cCl2.
Система уравнений, описывающих цепной процесс, может быть упрощена, отдельные реакции, роль которых несущественна, можно не принимать во внимание. Так, приняв, что при постоянной интенсивности освещения скорость зарождения цепей будет пропорциональна cCl2, а скорость обрыва цепи основном будет определяться столкновениями атомов хлора с молекулами М, концентрация которых остается постоянной см; процесс можно описать четырьмя уравнениями:
v0 = k0CCl2;
v1 = k1CCl*CH2;
v2 = k2CH*CCl2;
v5 = k5cMc2Cl*.
При достаточно длинной цепи, т. е. начиная с некоторого времени, скорость разложения Н2 должна равняться скорости разложения Сl2. Это условие может быть доказано на основе принципа стационарных концентраций. Так как концентрация радикалов Н* в системе очень мала, то можно принять 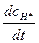 = 0:
= 0:
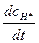 = v1 – v2 ; v1 = v2 ;
= v1 – v2 ; v1 = v2 ;
cH* = 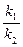 cCl*
cCl*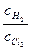 ;
;
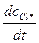 = v0 – v1 + v2 – v5;
= v0 – v1 + v2 – v5;
v0 – v5 = 0 v0 = v5;
k0cCl2 = k5c2Cl*;
cCl* = 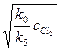 .
.
Общая скорость процесса
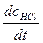 = v1 + v2 = 2k1cCl*cH2 = 2k1(
= v1 + v2 = 2k1cCl*cH2 = 2k1(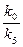 )1/2cH2c1/2Cl2 = kcH2c1/2Cl2.
)1/2cH2c1/2Cl2 = kcH2c1/2Cl2.
Примером цепной реакции с разветвляющейся цепью может служить взаимодействие водорода с кислородом
Н2 + О2 ® 2ОН* - зарождение цепи ;
ОН* + Н2 ® Н2О + Н*;
Н* + О2 ® ОН* + О*;
О* + Н2 ® ОН* + Н* - развитие цепи;
2Н* ® Н2;
2ОН* ® Н2О2 - обрыв цепи.
| <== предыдущая страница | | | следующая страница ==> |
| ТЕОРИЯ АКТИВНОГО КОМПЛЕКСА ИЛИ ПЕРЕХОДНОГО СОСТОЯНИЯ | | | ФОТОХИМИЧЕСКИЕ РЕАКЦИИ |
Дата добавления: 2014-03-11; просмотров: 403; Нарушение авторских прав

Мы поможем в написании ваших работ!