
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Модель атома водорода по Бору
Квантовые постулаты Бора – это два основных допущения, введённые Н.Бором для объяснения устойчивости атома и спектральных закономерностей (в рамках модели атома Резерфорда).
Планетарная модель атома Резерфорда позволила объяснить результаты опытов по рассеянию α - частиц вещества, но она не способна объяснить факт существования атома и его устойчивость.
В соответствии с планетарной моделью электроны атома должны двигаться вокруг неподвижного ядра. Двигаясь вокруг ядра с центростремительным ускорением под действием силы притяжения к ядру, электрон должен, как и всякий ускоренно движущийся электрический заряд, излучать электромагнитные волны с частотой, равной частоте обращения электрона вокруг ядра.
Энергия электрона в атоме должна при этом непрерывно уменьшаться за счёт излучения. Сам электрон должен с каждым оборотом приближаться по спирали к ядру и упасть на него под действием электрической силы притяжения. При этом атом потеряет всю электронную оболочку, а также присущие ему физические и химические свойства. Кроме того, атом должен потерять спектр излучения частоты, то есть атом должен давать излучение с непрерывным (сплошным) спектром частот.
Эти результаты, полученные с помощью классической механики и электродинамики, находятся в резком противоречии с опытом, который показывает, что
1. Атомы являются весьма устойчивыми системами и в невозбуждённом состоянии могут существовать неограниченно долго, не излучая при этом электромагнитные волны
2. Спектр излучения атома является линейчатым (дискретным) – образованным из отдельных линий (от латинского discretus – прерывистый, состоящий из отдельных значений).
Всё это свидетельствует о том, что законы классический физики применить к электронам в атомах нельзя, поэтому необходимы новые представления о механизме излучения и поглощения атомами электромагнитных волн. В основе современной теории атома лежит квантовая механика – теория, устанавливающая способ описания и законы движения микрочастиц (элементарных частиц, атомов, молекул, атомных ядер) и их систем (например, кристаллов), а также связь величин, которые характеризуют частицы и системы, с физическими величинами, измеряемыми опытным путём.
В 1913 году датский физик Нильс Бор (1885 – 1962) ввёл идеи квантовой теории в ядерную модель атома Резерфорда и разработал теорию атома водорода, которая подтвердилась всеми известными тогда опытами. Бор сформулировал в виде постулатов основные положения новой теории, которые налагали лишь некоторые ограничения на допускаемые классической физикой движения. Однако последовательной теории атома Бор не дал. Впоследствии теория Бора была включена как частный случай в квантовую механику. В основе теории Бора лежат два постулата.
Первый постулат Бора: постулат стационарных состояний
| Атомная система может находиться только в особых стационарных, или квантовых, состояниях, каждому из которых соответствует определённая энергия En. В стационарном состоянии атом не излучает. |
Второй постулат Бора: правило частот
| Излучение света происходит при переходе атома из стационарного состояния с большей энергией Ek в стационарное состояние с меньшей энергией En. Энергия излученного фотона равна разности энергий стационарных состояний: hvkn = Ek - En |
Частота излучения равна:
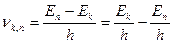
Или
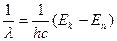
Где h – постоянная Планка, с – скорость света в вакууме.
Если Ek > En, то происходит излучение фотона, если Ek < En, то происходит поглощение фотона, при котором атом переходит из стационарного состояния с меньшей энергией в стационарное состояние с большей энергией. Таким образом, для каждого атома имеется ряд строго определённых дискретных значений энергии, которыми он может обладать. Физические величины, например энергия и импульс, которые могут принимать лишь дискретные (квантовые) значения, носят название квантованные физические величины (квантование физических величин). При этом энергетические уровни атома – это возможные значения энергии атома.
Правило квантования орбит позволяет определить радиусы стационарных орбит:
mvnrn = nh'
где n = 1, 2, 3…, m – масса электрона, rn – радиус n-ой орбиты, vn – скорость электрона на этой орбите.
Число n – положительное число, которое называется главное квантовое число.
Величина mvnrn – момент импульса электрона.
h' – это величина, которая равна:
h' = 1,05445887•10-34 Дж•с 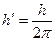
где h – постоянная Планка.
Главное квантовое число указывает номер орбиты, по которой может обращаться электрон.
Свои постулаты Н.Бор применил для построения теории простейшей атомной системы – атома водорода, состоящего из ядра – протона, и одного электрона. Эта теория также применима для водородоподобных ионов, то есть атомов с зарядом ядра Ze и потерявших все электроны, кроме одного (например, Li2+, Be3+ и т.п.). В предположении, что электрон движется по круговой орбите, постулаты Бора позволяют найти радиусы rn стационарных, возможных орбит электрона. На электрон действует кулоновская сила:
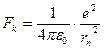
Где е – модуль заряда электрона, равный заряду ядра,
ε0 = 8,85418782 * 10-12 Ф/м – электрическая постоянная в единицах СИ.
Кулоновская сила сообщает электрону на орбите центростремительное ускорение:
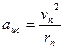
Согласно второму закону Ньютона:
Fk = maцс
Поэтому
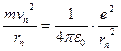
Или
mvn2rn = e2 / (4πε0)
Используя правило квантования орбит mvnrn = nh', можно получить выражения для возможных радиусов орбит. Исключая скорость vn из предыдущего выражения и подставляя в данное получим:
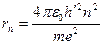 (так как h' = h / 2π)
(так как h' = h / 2π)
Таким образом, радиусы орбит электрона в атоме водорода прямо пропорциональны квадратам главного квантового числа n.
Наименьший радиус орбит при n = 1, то есть радиус первой орбиты в атоме водорода равен:
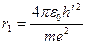 r1 = 0,528 * 10-10 м
r1 = 0,528 * 10-10 м
Радиус первой орбиты в атоме водорода носит название первый Боровский радиус и служит единицей длины в атомной физике.
Полная энергия Е электрона в атоме водорода, согласно механике Ньютона, равна сумме кинетической энергии Еk и потенциальной энергии П взаимодействия электрона с ядром:
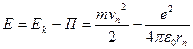
Потенциальная энергия электрона в атоме отрицательна:
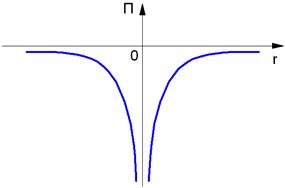
П = - e2 / (4πε0rn)
Так как нулевой уровень отсчёта берётся на бесконечности (рис. 1.3), а по мере приближения электрона к ядру его потенциальная энергия уменьшается. Взаимодействующие частицы – ядро и электрон – имеют заряды противоположных знаков.
| <== предыдущая страница | | | следующая страница ==> |
| Физика атома | | | Поглощение и испускание света атомом. Квантование энергии. Принцип действия и использования лазера |
Дата добавления: 2014-02-26; просмотров: 747; Нарушение авторских прав

Мы поможем в написании ваших работ!