
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Гальванические элементы. Гальваническим элементом (ГЭ) называют устройство, в котором энергия химической реакции непосредственно превращается в электрическую
Гальваническим элементом (ГЭ) называют устройство, в котором энергия химической реакции непосредственно превращается в электрическую. ГЭ состоит из соединенных между собой металлических электродов, погруженных в растворы их соли. Пластины металлов соединены через показывающий прибор. Полуэлементы соединяются в электрическую цепь с помощью трубки, заполненной токопроводящим раствором (так называемого солевого мостика). На рис.1. приведена схема медно-цинкового гальванического элемента (Якоби-Даниэля). −Zn/Zn2+/ /Cu2+/Cu+
 | |||
 | |||










 3
3

 1 5
1 5








 2 4
2 4
Zn Cu











































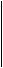



 - +
- +

ZnSO4 CuSO4
Рис. 1. Схема гальванического элемента: 1 - электрод (Zn); 2- сосуд с раствором ZnSO4; 3 - солевой мостик; 4- сосуд с раствором CuSO4; 5- электрод (Си).
1 - электрод (Zn); 2- сосуд с раствором ZnSO4; 3 - солевой мостик; 4- сосуд с раствором CuSO4; 5- электрод (Си).
Выписываем значения электродных потенциалов для цинка и меди из таблицы №3:
j 0 = 0,337 В j 0 = −0,763 В
Cu2+ / Cu0 Zn2+ / Zn0
 Металл, имеющий меньшее значение электродного потенциала считается анодоми он окисляется.
Металл, имеющий меньшее значение электродного потенциала считается анодоми он окисляется.
Видим, что значение потенциала для цинка меньше, чем для меди, делаем вывод, что цинк
 анод (выполняет функцию отрицательного электрода) А Zn0 - 2ē ® Zn2+
анод (выполняет функцию отрицательного электрода) А Zn0 - 2ē ® Zn2+

Металл, имеющий большее значение электродного потенциала считается катодоми он восстанавливается.
Реакция на правом электроде для меди, так как он катод (выполняет функцию положительного электрода) соответствует процессу восстановления:
 К Сu2+ + 2ē ® Cu0
К Сu2+ + 2ē ® Cu0
Гальванические элементы изображаются следующей записью:
− Zn0 / ZnSO4 / / CuSO4 / Cu0 + или в ионной форме: − Zn0 / Zn2+ / / Cu2+/ Cu0
в которой вертикальные линии символизируют границу металл - раствор, а двойная - границу между растворами электролитов.
РаботаГЭ оценивается величиной его Э.Д.С.(наибольшее напряжение, которое может дать ГЭ). ЭДС гальванического элемента представляет собой разность электродных потенциалов окислителя и восстановителя, то есть равна разности электродных потенциалов катода и анода.

Е = j К0 − jА 0 (1)
Электродный потенциал металла зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста : 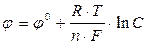
где j - стандартный потенциал металла, R - универсальная газовая постоянная, Т - абсолютная температура, n - число электронов, принимающих участие в процессе, F - число Фарадея 1F= 96500 Кл, С - концентрация ионов металла.
Если в приведенном уравнении заменить константы R и F их численным значениями, а натуральный логарифм десятичным, то оно примет следующий вид : 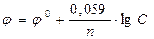
Если концентрации растворов у электродов неодинаковы, то сначала рассчитывают новые значения потенциалов для катода и анода с поправкой на концентрацию по уравнению Нернста, а затем подставляют в уравнение (1).
Концентрационный гальванический элемент (КГЭ)состоит из двух пластин одного металла, погруженных в растворы его соли, которые отличаются лишь концентрацией. −Zn0/Zn2+/ / Zn2+/Zn0+
 | |||
 | |||









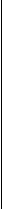

 3
3


 1 5
1 5








 2 4
2 4
Zn Zn











































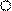
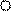
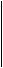



 - +
- +

ZnSO4 ZnSO4
С1 С2 Рис. 2. Схема гальванического элемента: 1,5 - электроды (Zn); 2, 4 - сосуды с раствором ZnSO4; 3 - солевой мостик.
1,5 - электроды (Zn); 2, 4 - сосуды с раствором ZnSO4; 3 - солевой мостик.
Электрод, который погружен в раствор с меньшей концентрацией считается анодом.
Допустим, С1 < С2, тогда левый электрод 1 является анодом, а правый электрод 2 будет катодом. КГЭ работает до тех пор, пока не выровняются концентрации С1’= C’2.
| <== предыдущая страница | | | следующая страница ==> |
| Электрохимия | | | Гальванические элементы. 1. Уяснить принцип работы гальванического элемента |
Дата добавления: 2014-03-17; просмотров: 380; Нарушение авторских прав

Мы поможем в написании ваших работ!