
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Гальванические элементы
Коммуникаторы - создание информационных сообщений
Задача коммуникатора - подготовка информ.сообщения кот. должны быть доступны и понятны для потенциальных потребителей, находящихся в разных регионах страны, континентов.
Коммуникаторы профессиональные:
1) Издатели-владельцы, акционеры, менеджеры спиндокторы ,и консультантов, исследовательские группы.
медиократы – владельцы акционеры, кот.влдаеют пакет акции.
Спиндокторы- люди кот.имеют возможность использовать на воздействие информ.сообщений, их отбор и способы освещения.
Деятельность :
· Отбор событий
· Подготовка события
· Проведение самого события
· Освещение событий СМИ
· Комментарий к событию
· Упоминание событий в списке однородных событий
· Отслеживание резонансных явлений в общественном мнении
2) Редакции – непосредственные создатели и передатчики текстов. Делятся на журналистов и prmen. Собирают информацию, создают первичный текст и выступают перед аудиторией.
Техники- те, кто обеспечивают материализацию текстов.
Факторы влияющие на освещение событий СМИ:
· Амплитуда между повторами аналогичных событий
· Частота повторов, просвещении в СМИ
· Неоднозначность события
· Релевантность события
· Событие ожидания
· Неординарные события
· Сохранение актуальности события
·
Как продвинуть события в СМИ
Контроль спин доктора
1) Контроль допуска на объект
2) Контроль информации
3) Контроль за передачей информации
4)
Гальванические элементы.
Гальванический элемент – это химический источник тока, то есть устройство, вырабатывающее электрическую энергию в результате прямого преобразования химической энергии окислительно-восстановительной реакции.
Электрический ток (направленное движение заряженных частиц) передается по проводникам тока, которые подразделяются на проводники первого и второго рода.
Проводники первого рода проводят электрический ток своими электронами (электронные проводники). К ним относятся все металлы и их сплавы, графит, уголь, а также некоторые твердые оксиды. Удельная электропроводность этих проводников находится в пределах от 102 до 106 Ом-1• см-1 (например, уголь – 200 Ом-1• см-1, серебро 6•105 Ом-1• см-1).
Проводники второго рода проводят электрический ток своими ионами (ионные проводники). Они характеризуются низкой электропроводностью (например, Н2О – 4•10-8 Ом-1• см-1).
При сочетании проводников первого и второго рода образуется электрод. Это чаще всего металл, опущенный в раствор собственной соли.
При погружении металлической пластинки в воду атомы металла, находящиеся в его поверхностном слое, под действием полярных молекул воды гидратируются. В результате гидратации и теплового движения связь их с кристаллической решеткой ослабляется и некоторое количество атомов, переходит в виде гидратированных ионов в слой жидкости, прилегающий к поверхности металла. Металлическая пластинка заряжается при этом отрицательно:
Ме + m Н2О = Меn+ • n Н2О + ne-
Где Ме – атом металла; Меn+ • n Н2О – гидратированный ион металла; e- – электрон, n – заряд иона металла.
Состояние равновесия зависит от активности металла и от концентрации его ионов в растворе. В случае активных металлов (Zn, Fe, Cd, Ni) взаимодействие с полярными молекулами воды заканчивается отрывом от поверхности положительных ионов металла и переходом гидратированных ионов в раствор (рис. 1а). Этот процесс является окислительным. По мере увеличения концентрации катионов у поверхности возрастает скорость обратного процесса – восстановления ионов металла. В конечном итоге скорости обоих процессов выравниваются, устанавливается равновесие, при котором на границе раствор-металл возникает двойной электрический слой с определенным значением потенциала металла.
Zn Cu
|
|




+ + – –
Zn0 + mH2O → Zn2+•mH2O+2e- + + – – Cu2+• nH2O+2e- → Cu0 + nH2O
+ + – –
+ + + – – –
 |  |
а б
Рис. 1. Схема возникновения электродного потенциала
При погружении металла не в воду, а в раствор соли этого металла равновесие смещается влево, то есть в сторону перехода ионов из раствора на поверхность металла. При этом устанавливается новое равновесие уже при другом значении потенциала металла.
Для неактивных металлов равновесная концентрация ионов металла в чистой воде очень мала. Если такой металл погрузить в раствор его соли, то катионы металла будут выделяться из раствора с большей скоростью, чем скорость перехода ионов из металла в раствор. В этом случае поверхность металла получит положительный заряд, а раствор – отрицательный из-за избытка анионов соли (рис. 1. б).
Таким образом, при погружении металла в воду или в раствор, содержащий ионы данного металла, на поверхности раздела фаз металл-раствор образуется двойной электрический слой, обладающий определенной разностью потенциалов. Потенциал электрода зависит от природы металла, концентрации его ионов в растворе и температуры.
Абсолютное значение электродного потенциала j отдельного электрода экспериментально определить нельзя. Однако можно измерить разность потенциалов двух химически различных электродов.
Условились принимать потенциал стандартного водородного электрода равным нулю. Стандартный водородный электрод представляет собой платиновую пластинку, покрытую губчатой платиной, погруженную в раствор кислоты с активностью ионов водорода, равной 1 моль/л. Электрод омывается газообразным водородом при давлении 1 атм. и температуре 298 К. При этом устанавливается равновесие:
2 Н+ + 2 е = Н2
За стандартный потенциал j0 данного металлического электрода принимается ЭДС гальванического элемента, составленного из стандартного водородного электрода и пластинки металла, помещенной в раствор соли этого металла, причем активность (в разбавленных растворах можно использовать концентрацию) катионов металла в растворе должна быть равна 1 моль/л; Т=298 К; р=1 атм. (стандартные условия). Значение стандартного электродного потенциала всегда относят к полуреакции восстановления:
Men++n e- → Me
Располагая металлы в порядке возрастания величины их стандартных электродных потенциалов j0, отвечающих полуреакции восстановления, получают ряд напряжений металлов (ряд стандартных электродных потенциалов). В этот же ряд помещают стандартный электродный потенциал системы, принимаемый за нуль:
Н++2е- → Н2
Зависимость электродного потенциала металла j от температуры и концентрации (активности) определяется уравнением Нернста, которое применительно к системе:
Men++ n e-→Me
Можно записать в следующем виде:
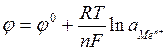 ,
,
где 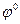 - стандартный электродный потенциал, В;
- стандартный электродный потенциал, В;
R – газовая постоянная, 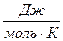 ;
;
F – постоянная Фарадея (»96500 Кл/моль);
n – число электронов, участвующих в процессе;
аМеn+ - активность ионов металла в растворе, моль/л.
Принимая значение Т=298К, получим
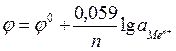
причем активность в разбавленных растворах можно заменить концентрацией ионов, выраженной в моль/л.
ЭДС любого гальванического элемента можно определить как разность электродных потенциалов катода и анода:
ЭДС = jкатода-jанода
Отрицательный полюс элемента называют анодом, на нем идет процесс окисления:
Ме - ne- → Men+
Положительный полюс называют катодом, на нем идет процесс восстановления:
Men+ + ne- → Ме
Гальванический элемент можно записать схематично, при этом соблюдаются определенные правила:
1. Электрод слева должен быть записан в последовательности металл – ион. Электрод справа записывается в последовательности ион – металл. (-) Zn/Zn2+//Cu2+/Cu (+)
2. Реакция, протекающая на левом электроде, записывается как окислительная, а реакция на правом электроде – как восстановительная.
3. Если ЭДС элемента > 0, то работа гальванического элемента будет самопроизвольна. Если ЭДС < 0, то самопроизвольно будет работать обратный гальванический элемент.
| <== предыдущая страница | | | следующая страница ==> |
| Структура и функции МК | | | Типы гальванических элементов. Аккумуляторы |
Дата добавления: 2014-05-28; просмотров: 482; Нарушение авторских прав

Мы поможем в написании ваших работ!