
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Изобразите в виде проекций Фишера и Хеуорса аномер a-L- арабинопиранозы
5. Из перечисленных соединений выберите монозы, являющиеся диастереомерами: а) D-идоза; б) L-талоза; в) D-арабиноза; г) D-псикоза; д) L-альтроза; е) L-эритрулоза.
6. Из перечисленных соединений выберите монозы, образующиеся в процессе кето-енольной таутомерии из D-сорбозы (в щелочной среде): а) D-тагатоза; б) L-сорбоза; в) D-гулоза; г) D-галактоза; д) L-идоза; е) D-идоза.
7. Какие из приведённых углеводов дают реакцию «серебряного зеркала»: а) сахароза, б) манноза, в) крахмал, г) целлюлоза, д) мальтоза?
8. При восстановлении глюкозы образуется: а) гликозид, б) сложный эфир, в) шестиатомный спирт, г) енол.
9. В гепарине в состав повторяющихся дисахаридных единиц входят остатки D- глюкозамина, D- глюкуроновой и L-идуроновой кислот. К каким соединениям относится гепарин: а) гомополисахариды; б) трисахариды; в) гетерополисахариды; г) карбоновые кислоты.
ТЕМА 13. Нуклеотиды и нуклеиновые кислоты
Нуклеиновые кислоты (полинуклеотиды) – это биополимеры, мономерными звеньями которых являются нуклеотиды.
Нуклеотид представляет собой трехкомпонентную структуру, состоящую из моносахарида, связанного N-гликозидной связью с гетероциклическим основанием и сложноэфирной связью с остатком фосфорной кислоты.
Важнейшими нуклеиновыми кислотами являются дезоксирибонуклеиновая (ДНК) и рибонуклеиновая (РНК), моносахаридные компоненты которых представляют собой 2-дезоксирибозу и рибозу соответственно. При гидролизе нуклеотидов в щелочной среде гидролитическому расщеплению подвергается только сложноэфирная связь, и образуются нуклеозиды, состоящие из остатка монозы и основания. Нуклеотиды подвергаются гидролизу только в кислой среде.
Нуклеиновые основания. Являются производными азотсодержащих гетероциклических соединений — пиримидина или пурина. Пиримидиновые основания, выделенные в составе полинуклеотидных цепей ДНК, представлены тимином и цитозином; в составе РНК – урацилом и цитозином. Данные соединения обнаруживают способность к лактим-лактамной таутомерии
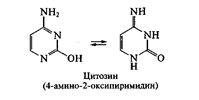
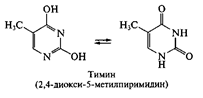
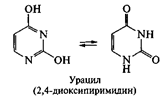
Следует отметить, что пиримидиновые основания в составе полинуклеотидов представлены лактамной формой (содержащей карбонильныю группы С=О), что обусловлено возможностью образования водородных связей между остатками оснований в цепях нуклеиновых кислот: тимин – аденин; цитозин – гуанин в ДНК; урацил – аденин и цитозин – гуанин в РНК.
Аденин и гуанин являются представителями пуриновых нуклеиновых оснований. Эти гетероциклические соединения способны к лактим-лактамнойтаутомерии и таутомерии азолов
 | |||
 | |||
В лактамной и лактимной гетероциклы имеют ароматический характер и плоское строение. Ароматичность гетероциклов является причиной их высокой термодинамической стабильности.
Нуклеозиды.
Гетероциклические основания образуют N-гликозиды с D-рибозой или 2-дезокси-D-рибозой. В химиии нуклеиновых кислот такие N-гликозиды называют нуклеозидами. D-рибоза и 2-дезокси- D -рибоза в состав природных нуклеозидов входят в фуранозной форме. Гликозидная связь осуществляется между аномерным атомом углерода С-1 рибозы (или дезоксирибозы) и атомом азота N-1 пиримидинового и N-9 пуринового оснований. Природные нуклеозиды всегда b-аномеры.
В зависимости от природы углеводного остатка различают рибонуклеозиды и дезоксирибонуклеозиды. Названия нуклеозидов строятся как для гликозидов, например b- аденинрибофуранозид и т. п. Однако более употребительны названия, производимые от тривиального названия соответствующего нуклеинового основания с суффиксами -идин у пиримидиновых и -озин у пуриновых нуклеозидов: цитидин — это соединение цитозина и рибозы; дезоксицитидин — цитозина и дезоксирибозы; аденозин — соединение аденина и рибозы; дезоксицитидин — аденина и дезоксирибозы и т.д. Исключение составляет название тимидин (а не дезокситимидин), используемое для дезоксирибозида тимина, входящего в состав ДНК. В тех редких случаях, когда тимин встречается в РНК, соответствующий нуклеозид называется риботимидином.
 |
Являясь N-гликозидами, нуклеозиды устойчивы к гидролизу а слабощелочной среде, но расщепляются в кислой. Пуриновые нуклеозиды гидролизуются легко, пиримидиновые труднее. В состав некоторых РНК входят необычные нуклеозиды. Например, довольно часто встречаются рибонуклеозид инозин, который можно рассматривать как продукт дезаминирования аденозина, а также псевдоуридин, который является не N-, а С-гликозидом, с чем связана его высокая устойчивость к гидролизу.
При лечении некоторых опухолевых заболеваний в качестве лекарственных средств используют синтетические производные пиримидинового и пуринового рядов, по строению похожие на естественные метаболиты (в данном случае – на нуклеиновые основания), но не полностью им идентичные, т. е. являющиеся антиметаболитами. Например, 5-фторурацил выступает в роли антагониста урацила и тимина, 6-меркаптопурин – аденина. Конкурируя с метаболитами, они нарушают на разных этапах синтез нуклеиновых кислот в организме.
В клетках в свободном состоянии содержатся некоторые нуклеозиды, не являющиеся компонентами нуклеиновых кислот. Эти нуклеозиды обладают антибиотической активностью и приобретают все большее значение при лечении злокачественных образований. Нуклеозиды-антибиотики отличаются от обычных нуклеозидов некоторыми деталями строения либо углеводной части, либо гетероциклического основания.
Нуклеотиды.
Нуклеотидами называются фосфаты нуклеозидов. Фосфорная кислота обычно этерифицирует спиртовый гидроксил при С-5' или С-3' в остатке рибозы или дезоксирибозы (атомы цикла азотистых оснований нумеруют обычными цифрами, пентозного цикла – цифрами со штрихом). Нуклеотиды можно рассматривать, с одной стороны, как эфиры нуклеозидов (фосфаты), с другой — как кислоты (в связи с наличием остатка фосфорной кислоты).
За счет фосфатного остатка нуклеотиды проявляют свойства двухосновной кислоты и в физиологических условиях при рН » 7 находятся в полностью ионизированном состоянии.
Для нуклеотидов используют два вида названий. Одно включает наименование нуклеозида с указанием положения в нем фосфатного остатка (например, аденозин-3'-фосфат, уридин-5'-фосфат), другое строится с добавлением суффикса -овая кислота к названию остатка пиримидинового или пуринового оснований (например, 3'-адениловая или 5'-уридиловая кислота)). По отношению к свободным нуклеотидам в биохимической литературе широко используются их названия как монофосфатов с отражением этого признака в сокращенном коде, например, аденозинмонофосфат – AMФ (в латинской транскрипции АМР) для аденозин-5'-фосфата и т.д.
Строение некоторых нуклеотидов:

 Глицерофосфолипиды являются производными фосфатидовых сислот (X = Н), в которых остаток фосфорной кислоты этерифицирован одним из аминоспиртов: коламином, холином или аминокислотой серином:
Глицерофосфолипиды являются производными фосфатидовых сислот (X = Н), в которых остаток фосфорной кислоты этерифицирован одним из аминоспиртов: коламином, холином или аминокислотой серином:
 |
Молекулы глицерофосфолипидов включают гидрофильную полярную группировку и две гидрофобные неполярные углеводородные цепи, что обусловливает дифильность молекул и выраженную поверхностную активность фосфолипидов.
Сфингофосфолипиды похожи по структуре на глицерофосфолипиды, но вместо глицерина используется другой спирт — сфингозин:
 |
Важную группу сфинголипидов составляют сфингомиелины, впервые обнаруженные в нервной ткани. В сфингомиелинах (в отличие от церамидов) гидроксильная группа у первого атома углерода ацилирована фосфорилхолиновой группировкой.
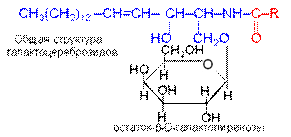
 Молекулы гликолипидов содержат остатки углеводов (чаще D-галактозы, реже D-глюкозы) и не содержат фосфорной кислоты и связанных с ней азотистых оснований. Типичные представители гликолипидов — цереброзиды и ганглиозиды.
Молекулы гликолипидов содержат остатки углеводов (чаще D-галактозы, реже D-глюкозы) и не содержат фосфорной кислоты и связанных с ней азотистых оснований. Типичные представители гликолипидов — цереброзиды и ганглиозиды.
Ганглиозиды структурно схожи с цереброзидами, но вместо моносахарида содержат сложный олигосахарид.
Характерной особенностью сложных липидов является их бифильность (наличие сродства как к полярным, так и к неполярным фазам). В фосфолипидах, например, углеводородные радикалы жирных кислот образуют два неполярных «хвоста», а карбоксильная, фосфатная и азотистая части — полярную «голову». На границе раздела фаз такие вещества проявляют поверхностно-активные свойства, так как одна их часть может растворяться в полярной фазе, а другая — в неполярной.
Липиды в организме выполняют структурную функцию, являясь, наряду с белками, компонентами внутриклеточных мембран и клеточных оболочек. За счёт гидрофобных взаимодействий углеводородные цепочки радикалов жирных кислот удерживаются рядом друг с другом в вытянутом состоянии во внутренней полости, образуя двойной углеродный слой; тогда как полярные группы взаимодействуют с белковыми молекулами и располагаются на внешней поверхности липидного бислоя.
Фосфолипиды обеспечивают высокое электрическое сопротивление и одностороннюю проницаемость (полупроницаемость) мембран: мембраны непроницаемы для ионов и полярных молекул и проницаемы для неполярных веществ. Поэтому для большинства анестезирующих препаратов характерна высокая растворимость в липидах, обеспечивающая их проникновение через мембраны нервных клеток.
Липиды мембран представлены в основном фосфолипидами, кроме того присутствуют сфинголипиды, гликолипиды и стероиды.
Неомыляемые липиды
Вместе с омыляемыми липидами в липидных фракциях, извлекаемых из материала животного или растительного происхождения, содержатся в небольшом количестве вещества, обладающие высокой биологической активностью. К ним относятся стероиды, терпены, жирорастворимые витамины, алкалоиды, объединяемые общим названием — низкомолекулярные биорегуляторы. За этими веществами закрепилось и ещё одно название — неомыляемые липиды, эти соединения не подвергаются гидролизу с образованием кислоты и спирта.
Стероиды
Стероиды широко распространены в природе, выполняют в организме разнообразные функции. К настоящему времени известно около 20 000 стероидов; более 100 из них применяется в медицине. Стероиды имеют циклическое строение. В основе их структуры скелет стерана, состоящий их трех конденсированных циклогексановых колец в нелинейном сочленении и циклопентанового кольца. Общая структура стероидов и нумерация атомов в стеране приведены ниже:
 |
Стероидные гормоны
Гормоны – биологически активные вещества, образующиеся в результате деятельности желез внутренней секреции и принимающие участие в регуляции обмена веществ и физиологических функций в организме.
Гормоны — промежуточное звено между нервной системой и ферментами. Синтезированные в железах внутренней секреции гормоны переносятся током крови к органам-мишеням и там либо повышают каталитическую активность соответствующих ферментов, либо ускоряют их биосинтез. Гормоны имеют не только стероидную структуру, они могут быть производными аминокислот, пептидов и белков.
Кортикостероиды (кортикоиды) образуются в корковом веществе надпочечников и регулируют углеводный и солевой обмен. Их боковая цепь у С17 включает два атома углерода в виде гидроксикетонной группировки. Примерами служат кортикостерон и преднизолон. Кортикостерон действует как антагонист инсулина, повышая содержание глюкозы в крови. Преднизолон – синтетический кортикостероид, по действию превосходящий свои природные аналоги. Используется для лечения ревматизма, бронхиальной астмы.
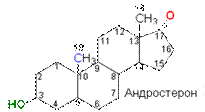
Андрогены стимулируют развитие вторичных половых признаков, влияют на эндокринную систему, обладают сильным анаболическим эффектом.
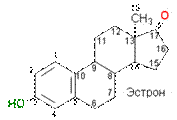

 Эстрогены контролируют некоторые важные циклы в женском организме, используются при лечении гипертонии и других заболеваний.
Эстрогены контролируют некоторые важные циклы в женском организме, используются при лечении гипертонии и других заболеваний.
Стерины
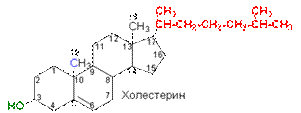
Как правило, клетки очень богаты стеринами. В зависимости от источника выделения различают зоостерины (из животных), фитостерины (из растений), микостерины (из грибов) и стерины микроорганизмов. В основе структуры стеринов лежит скелет углеводорода холестана, алифатический радикал R которого включает 8 атомов углерода.
В качестве обязательного заместителя стерины содержат гидроксильную группу при С3, т. е. являются вторичными спиртами (поэтому в их названии часто присутствует окончание -ол). Примерами служат встречающиеся в животных клетках холестанол, относящийся к 5a-стероидам; холестерин и др.
Из общего количества холестерина, содержащегося в организме (250 г при массе тела 65 кг), только около 20 % его поступает с пищей. Основное количество холестерина синтезируется в организме. Нарушение обмена холестерина приводит к отложению его на стенках кровеносных сосудов и, как следствие, к уменьшению эластичности сосудов (атеросклерозу). Кроме того, он может накапливаться в виде желчных камней.
 |
Желчные кислоты
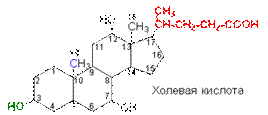
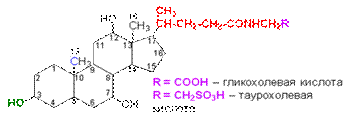
В печени стерины, в частности холестерин, превращаются в желчные кислоты. Алифатическая боковая цепь у С17 в желчных кислотах, производных углеводорода холана, состоит из 5 атомов углерода и включает концевую карбоксильную группу. Из желчи человека выделены четыре кислоты, которые получили название холевых кислот. Наиболее распространенная — сама холевая кислота.
Другие холевые кислоты отличаются отсутствием одной или двух гидроксильных групп у С7 и С12. Желчные кислоты находятся в организме также в виде амидов по карбоксильной группе (посредством пептидной связи к ним присоединены остатки глицина Н2NСН2СООН или таурина H2NCH2CH2SO3H). Haтриевые и калиевые соли этих соединений обладают поверхностно-активными свойствами. Эмульгируя жиры пищи, они улучшают их усвоение, а также активируют липазу — фермент, катализирующий гидролиз жиров.
 |  |
Терпены и терпеноиды
Под этим названием объединяют ряд углеводородов и их кислородсодержащих производных — спиртов, альдегидов и кетонов, углеродный скелет которых построен из двух, трех и более звеньев изопрена. Сами углеводороды называют терпеновыми углеводородами, а их кислородсодержащие производные — терпеноидами. Терпенами богаты эфирные масла растений, смола хвойных деревьев и каучуконосов. К терпенам относятся и различные растительные пигменты и некоторые жирорастворимые витамины. Группировка терпенового типа (изопреноидная цепь) включена в структуру многих биологически активных соединений.
Общая формула большинства терпеновых углеводородов — (C5H8)n. Они могут иметь нециклическое и циклическое строение. Терпены, содержащие две изопреновые группировки, относят к монотерпенам, три — к сесквитерпенам, четыре, шесть и восемь — к ди-, три- и тетратерпенам соответственно.
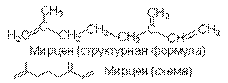
 Примерами ациклических терпенов служат мирцен — монотерпен, содержащийся в эфирных маслах хмеля и благородного лавра; родственный мирцену спирт гераниол, содержащийся в эфирных маслах герани и розы.
Примерами ациклических терпенов служат мирцен — монотерпен, содержащийся в эфирных маслах хмеля и благородного лавра; родственный мирцену спирт гераниол, содержащийся в эфирных маслах герани и розы.
Среди терпенов наиболее распространены моно- и бицикли-ческие терпены. Многие из них применяются в медицине или служат исходными продуктами для синтеза лекарственных средств.
(-)-Лимонен – представитель моноциклических терпенов. Он содержится в лимонном масле и скипидаре. (+)-Лимонен входит в состав масла тмина. Рацемическая форма лимонена (дипентен) может быть получена в результате реакции диенового синтеза из изопрена при нагревании.
При восстановлении оптически активного лимонена или дипентена получается ментан, а при полной их гидратации в кислой среде, протекающей в соответствии с правилом Марковникова, образуется двухатомный спирт терпин. Последний в виде гидрата применяется как отхаркивающее средство при хроническом бронхите. Замещенные дипентены (например, каннабидиол) — психоактивное начало гашиша (марихуаны).
(-)-Ментол, как и лимонен, имеет скелет ментана. Он содержится в эфирном масле перечной мяты. Оказывает антисептическое, успокаивающее и болеутоляющее (отвлекающее) действие, входит в состав валидола, а также мазей, применяемых при насморке.
 | |||
 | |||
Особую группу терпенов составляют каротиноиды – растительные пигменты. Некоторые из них играют роль витаминов или предшественников витаминов, а также участвуют в фотосинтезе. Большинство каротиноидов относится к тетратерпенам. Их молекулы содержат значительное число сопряженных двойных связей и поэтому окрашены. Для природных каротиноидов характерна транс-конфигурация двойных связей.
Каротин — растительный пигмент желто-красного цвета, в большом количестве содержащийся в моркови, а также томатах и сливочном масле. Известны три его изомера, называемые a-, b-, и -g-каротинами, различающиеся числом циклов и положением двойных связей. Все они предшественники витаминов группы А.
Витамины
Витаминами обычно называют органические вещества, присутствие которых в небольшом количестве в пище человека и животных необходимо для их нормальной жизнедеятельности.
Это классическое определение в настоящее время используется с некоторыми оговорками. Термин «витамины», т. е. «амины жизни» (от лат. vita — жизнь), своим возникновением обязан тому, что первые выделенные витамины принадлежали к классу аминов. Однако позднее выяснилось, что присутствие аминогруппы в витаминах необязательно. Витамины делят на две большие группы – водорастворимые и жирорастворимые.
Кроме этих групп витаминов, выделяют витаминоподобные вещества, например холин, инозит, оротовая, п-аминобензойная, линолевая, линоленовая кислоты и др.
Житрорастворимые витамины
Витамин А относится к сесквитерпенам, содержится в масле, молоке, яичном желтке, рыбьем жире; свиное сало и маргарин его не содержат. Это витамин роста; недостаток его в пище вызывает убыль в весе, высыхание роговицы глаз, понижение сопротивляемости к инфекции, играет ведущую роль в процессе светоощущения.
В организме человека каротин превращается в витамин А.
Витамины группы D относятся к классу стероидов, содержатся в рыбьем жире и яичном желтке (противорахитные). При их недостатке неправильно развивается костная ткань, нарушается обмен кальция и фосфора. Витамины группы D усиливают сопротивляемость инфекции.
Витамины К и К1 (филлохинон) являются производными нафтохинона, содержатся во многих растительных продуктах, регулируют в печени синтез протромбина, обусловливающего нормальное свертывание крови. Синтетический водорастворимый аналог витаминов группы К – викасол повышает способность крови к свёртыванию.
Витамины группы Е находятся в растительных маслах, молоке, яичном желтке, зародышах пшеницы, кукурузы т.п., регулируют функции половых желез (витамины размножения).

Водорастворимые витамины
В конце прошлого века тысячи моряков на японских судах страдали, а многие из них умирали мучительной смертью от таинственной болезни «бери-бери». Одной из загадок бери-бери было то, что моряки на судах других стран этой болезнью не болели. В 1882 г. японский морской врач Канегиро Такаки в своей работе, вполне заслуживающей названия «медицинского детектива», показал, что решение проблемы борьбы с этой болезнью заключается в правильном питании. Он обнаружил, что замена очищенного риса, составлявшего в основном рацион питания японских моряков, неочищенным не только помогает излечиться от болезни, но и предотвращает ее появление. Такаки предположил, что в рисовой шелухе содержатся какие-то важные белки, которых недоставало в пище болевших матросов. Последующая работа показала, что такое предположение правильно лишь отчасти. В рисовой шелухе действительно находится -существенно важный для правильного питания фактор, однако вещество это не является белком. Это небольшая органическая молекула, называемая тиамином, который служит коферментом, т. е. действует вместе с ферментом (являющимся белком), катализируя специфические химические реакции.
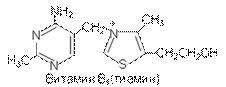 Витамин В1 является производным пиримидина, содержится
Витамин В1 является производным пиримидина, содержится
в дрожжах, ростках пшеницы, шпинате, капусте, моркови, бобах,
в печени животных. Вырабатывается кишечной флорой.
Регулирует углеводный обмен в организме, недостаток
его нарушает функции сердца и нервной системы.
Витамин В2 (рибофлавин) – производное бензоптеридина содержится в яйцах, молоке, печени. У травоядных животных вырабатывается микробами в пищеварительном тракте. Регулирует работу ферментов, участвует в процессах тканевого дыхания. При недостатке этого витамина замедляется рост, наблюдаются воспалительные процессы слизистой оболочки языка и губ, развивается общая мышечная слабость и слабость сердечной мышцы.
Витамин В6 представлен тремя формами (витамерами) – производными пиридина – пиридоксином (пиридоксолом), пиридоксалем и пиридоксамином. Он имеет важное физиологическое значение. При недостатке его в организме задерживается рост молодняка (и особенно цыплят), развивается заболевание кожи у животных (вокруг глаз, рта и носа). У человека недостаточность витамина В6 встречается реже, выражается в дерматитах. Фосфорилированные производные пиридоксаля и пиридоксамина играют роль коферментов.
 |
Драматическая история, связанная с витамином С, возвращает нас к началу XVII в. Купцы-мореплаватели Британской Ост-Индской компании для того, чтобы не заболеть цингой, сосали плоды цитрусовых. Отсюда и происходит кличка «лимонники», как называли в те дни английских матросов и до сих пор иногда называют англичан. Однако гораздо легче вынести обидную кличку, чем ужасные последствия болезни, связанной с недостатком витаминов.
При заболевании цингой десны начинают кровоточить, происходят кровоизлияния под кожей и в суставах. Кожа становится дряблой, суставы распухают. Даже легкое прикосновение к больному может вызвать у него сильнейшую боль. Без приема витамина С неизбежно наступает смерть. В наши дни цинга не представляет серьезной проблемы, но недостаток витамина С ухудшает заживляемость ран и сопротивляемость организма инфекции.
Среди болезней, причиной которых является недостаток витаминов, более серьезную проблему, чем цинга или бери-бери, представляла пеллагра. Пеллагра начинается с дерматитов и аномальной пигментации кожи и сопровождается нервными и желудочно-кишечными расстройствами, потерей памяти; в конце концов наступают тяжелое расстройство психики и смерть.
То, что эта болезнь связана с недостаточным питанием, известно с 1914 г., однако вначале полагали, что ее вызывает недостаток белка в пище. В 1937 г. установили, что антипеллагрическим действием обладают никотиновая кислота и её амид – витамин РР (от итал preventive pellagra – предотвращающий пеллагру). Свое название кислота получила от никотина, окислением которого ее получают.
 |
Алкалоиды
К алкалоидам относят различные вещества растительного происхождения, которые содержат азотистый гетероцикл, обладающие основными свойствами и специфическим действием на животный организм. Например, атропин расширяет зрачок, возбуждает нервную систему, морфин успокаивает ее, хинин действует на плазмодии малярии. Благодаря специфичности физиологического действия многие алкалоиды стали лекарственными веществами.
Различают шесть групп алкалоидов со следующими важнейшими представителями: пиридиновая (никотин), хинолиновая (хинин, стрихнин), изохинолиновая (папаверин, кураре), фенантреновая (кодеин, морфин), тропиновая (атропин) и пуриновая (кофеин).
Кроме того, алкалоиды подразделяют на бескислородные (никотин, анабазин и др.) и кислородсодержащие (хинин, атропин и др.). Все алкалоиды горьки на вкус, вращают плоскость поляризации влево, плохо растворимы в воде, используются в виде солей (хлоридов или сульфатов), которые лучше растворимы. Описано более 500 алкалоидов, изучено строение многих из них, некоторые синтезированы.
Чаще всего алкалоиды встречаются у высших растений (маковых, бобовых, лютиковых); алкалоиды могут находиться в различных органах: никотин – в листьях табака, хинин – в коре дерева. Растения, содержащие 1-2 % алкалоида, считают хорошим сырьем для переработки. В растениях алкалоиды связаны (в виде солей лимонной, щавелевой и других кислот). Выделение их из растительного материала весьма затруднительно. Очищают выделенные алкалоиды перекристаллизацией, распознают с помощью цветных реакций.
Никотин содержится в листьях и семенах табака (от 1 до 7% в виде соединений с яблочной и лимонной кислотами), имеет вид бесцветной маслянистой жидкости, кипящей при 247 °С, обладает левым вращением, ядовит, добывается из отходов табачной промышленности, применяется как инсектицид.
Изомер никотина - анабазин имеет вид бесцветного масла, кипящего при 276 °С, очень ядовит, применяется для борьбы с насекомыми (в виде сернокислой соли), чрезвычайно токсичен.
Хинин содержится в коре хинного дерева, кислородсодержащий алкалоид, кристаллизуется с тремя молекулами воды, плохо растворим в ней, обладает левым вращением, применяется как антималярийное лекарство (в виде хлористоводородной или сернокислой соли). Сернокислый хинин с бромной водой и водным аммиаком дает зеленое окрашивание. Синтезирован в 1945 г.
Примером алкалоида изохинолинового ряда является папаверин, применяющийся в качестве эффективного противосудорожного средства.

Атропин содержится в белладонне, семенах дурмана, белене. Это кристаллическое вещество, плавящееся при 115-116 °С, ядовит, вызывает расширение зрачка, несмотря на высокую токсичность, применяется при лечении глазных заболеваний.
Кокаин содержится в листьях кока, имеет вид бесцветных призм, плавящихся при 98 °С. Известен как одно из первых используемых в медицине местноанестезирующих и наркотических средств.
Морфин был первым алкалоидом, выделенным в чистом виде (1806 г). Он был назван по имени сына бога сна и сновидений Морфея, его применяют как снотворное и обезболивающее средство.
 Кодеин – метиловый эфир морфина, используется против кашля и в качестве обезболивающего средства.
Кодеин – метиловый эфир морфина, используется против кашля и в качестве обезболивающего средства.
Большим успехом органической химии явилось выделение и изучение антибиотиков – природных веществ, синтезируемых микроорганизмами и тормозящих размножение других микроорганизмов. Антибиотики применяются для лечения и предупреждения многих инфекционных заболеваний. Получены десятки антибиотиков, отличающихся как по химическому строению, так и по силе противобактериального действия. Среди них есть и сравнительно простые вещества класса хинонов и сложные гетероциклические соединения, вещества углеводного характера, полипептидные соединения. Наибольшее медицинское значение приобрели пенициллин, стрептомицин, грамицидин, синтомицин и биомицин.
Счастливая случайность позволила английскому бактериологу А. Флемингу в 1929 г. впервые наблюдать противомикробную активность пенициллина. Культуры стафилококка, выращивавшиеся на обычной питательной среде, называемой агаром случайно были заражены зеленой плесенью. Флеминг заметил, что по мере развития зеленой плесени стафилококковые палочки, находящиеся по соседству с плесенью, разрушались. Затем он обнаружил, что сама питательная среда, в которой развивалась плесень, не причиняла вреда лейкоцитам крови, и предположил, что содержащееся в плесени активное начало может быть использовано в качестве антисептика. Впоследствии было установлено, что плесень эта относится к виду Penicillium notatum, однако в то время возможность использования выделяемого ею вещества для лечения общих инфекционных заболеваний не была исследована.
 За несколько лет до начала второй мировой войны X. Флори и
За несколько лет до начала второй мировой войны X. Флори и
Е. Чейн в Оксфорде решили разобраться в причинах этого явления.
В 1940 г. они выделили натриевую соль пенициллина, содержащую
примеси. Им удалось показать, что полученное вещество обладает
замечательной противостафилококковой активностью. В начале 1941 г. пенициллин был впервые опробован на человеке – им был заболевший оксфордский полицейский – и начался путь этого антибиотика к славе.
Эра синтетических лекарств началась лавинообразным увеличением числа исследований во всем мире после опубликования в 1936 г. сообщения о том, что известная молекула сульфаниламида обладает почти сверхъестественной силой излечивать самые различные, часто смертельные инфекционные заболевания.
Молекула сульфаниламида поразительно проста. Как же действует эта небольшая молекула, метко убивающей бактерию и не приносящей никакого вреда живым клеткам?
Сульфаниламид убивает бактерии, включаясь в синтез фолиевой кислоты. Синтез фолиевой кислоты чрезвычайно важен для жизнедеятельности бактерий. Животные клетки сами не синтезируют фолиевую кислоту, однако она является необходимым компонентом в их «рационе».
Сульфаниламид мешает биосинтезу фолиевой кислоты, конкурируя с п-аминобензойной кислотой за включение в молекулу фолиевой кислоты. Структура сульфаниламида близка к структуре п-аминобензойной кислоты, что позволяет молекуле сульфаниламида «ввести в заблуждение» ферменты, отвечающие за связывание всех трех частей молекулы.
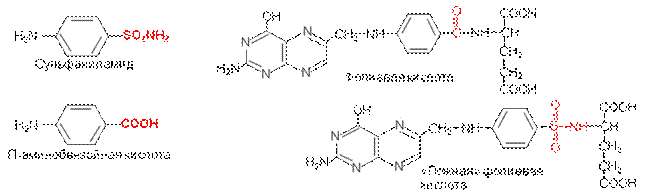 |
Таким образом, сульфаниламид занимает место п-аминобензойной кислоты, давая «ложную» молекулу фолиевой кислоты, которая, вероятно, не способна выполнять жизненные функции «истинной» фолиевой кислоты внутри бактерии. В этом заключается секрет противобактериальной активности сульфаниламида.
| <== предыдущая страница | | | следующая страница ==> |
| Моносахариды подвергаются химическому либо билогическому восстановлению | | | наркомании и токсикомании |
Дата добавления: 2014-04-05; просмотров: 1643; Нарушение авторских прав

Мы поможем в написании ваших работ!