
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ТЕОРЕТИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ ОРГАНИЧЕСКОЙ ХИМИИ
Термин «органическая химия» возник достаточно давно, еще в IV в. н.э. люди научились использовать органическое сырье и перерабатывать его: делать пищу более вкусной и увеличивать ее сохранность, дубить кожу, делать пьянящие напитки (вино, брагу, напитки из меда), варить мыло, красить кожу, приготавливать целебные отвары и мази.
Последующий период – период алхимии, поиск «философского камня», эликсира долголетия. В это время химические соединения разделили по вкусовым свойствам – масло, серная кислота и оливковое масло.
С конца ХVI в. темпы изучения химии сильно возросли, и уже к концу ХIХ в. шведский ученый Берцелиус выделил органическую химию как самостоятельную науку. Считалось, что органические вещества могут быть получены с помощью «жизненной силы» (витализм). Дальнейшие исследования в отношении органической химии опровергли эту теорию. Так, Велер синтезировал из неорганических веществ KCN и сульфата аммония органическое вещество – мочевину, Зинин из нитробензола синтезировал анилин. Таким образом было доказано, что органические вещества могут быть получены синтетическим путем.
В дальнейшем под органической химией стали понимать химию углерода, хотя некоторые соединения этого элемента рассматриваются в неорганической химии.
Дальнейшее развитие теоретических представлений органической химии привело к бурному развитию органического синтеза, в том числе сложных органических соединений (антибиотиков, липидов, углеводов, белков, красителей, пигментов и других веществ). Отдельные разделы органической химии развивались так интенсивно, что выросли в самостоятельные науки: биохимия, химия высокомолекулярных соединений (ВМС), белков, липидов, витаминов и т.д.
Нами будут рассмотрены соединения углерода с атомами N, P, O, S, Гal, H, которые называются органогенами. Соединений углерода с органогенами известно более 5 млн., потенциальное число бесконечно.
Органическая химия занимается вопросами классификации органических соединений, их номенклатурой, электронным и геометрическим строением, определяет физические и химические свойства органических соединений. Представления органической химии возникли в результате более векового изучения органических соединений, развития учения о строении и свойствах углерода.
I этап развития органической химии – до 60-х гг. прошлого столетия. Было установлено, что свойства органических соединений обусловлены не только брутто-формулой, но и внутренней упорядоченностью молекулы. Эта идея воплотилась через теорию радикалов, а затем теорию типов.
Теория радикалов. Родоначальниками этой теории были Дюма, Либих, Берцелиус. Сущность теории заключалась в следующем: одна часть органической молекулы – «радикал» – не изменяется, а переходит из одного соединения в другое (CH3CH2OН, СН3СН2Сl). Позднее было установлено, что в результате некоторых реакций радикал изменяет свое строение, при этом свойства вещества существенно не меняются:
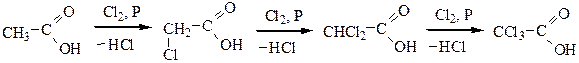
Таким образом, наличие фактов изменяемости радикалов требовало создания новой теории.
Теория типов. Жерар и Лоран уделили внимание той части молекулы, которая может изменяться в результате реакции. Согласно этой теории, органические вещества рассматривались как производные неорганических веществ, в которых атомы водорода замещены на радикалы. Было открыто 4 основных типа – тип водорода, тип воды, тип хлористого водорода и тип аммиака:
 тип водорода
тип водорода
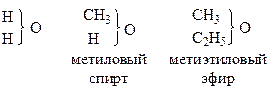
тип воды
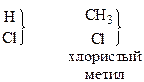 тип хлористого водорода
тип хлористого водорода
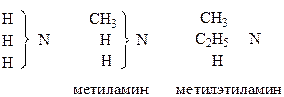 тип аммиака
тип аммиака
В отличие от теории радикалов, авторы главное внимание уделяли изменяемой части молекулы, которая определяла ее основные химические свойства. Таким образом была установлена взаимосвязь между свойствами органических и неорганических веществ.
К концу 60-х гг. XIX в. накопился большой экспериментальный материал, ставящий под сомнение теорию типов. К этому времени было установлено, что углерод – четырехвалентен (Кольбе, Кекуле). Купер предложил систему изображения строения химических соединений, в которой связи указываются с помощью черточек. К сожалению, типовые формулы не могли объяснить некоторые химические свойства и пути получения органических соединений. Дальнейшее развитие науки требовало новых теоретических представлений.
В 1886 г. выдающийся русский химик Александр Михайлович Бутлеров предложил теорию строения органических соединений. Сущность теории состоит в следующем:
1. свойства органических веществ определяются не только природой и количеством входящих в состав молекулы атомов, но и порядком их соединения (т.е. химическим строением);
2. атомы, входящие в состав молекулы органического вещества, оказывают взаимное влияние друг на друга и на свойства молекулы;
3. химическая структура молекулы может быть представлена только одной формулой.
Продолжателем этой теории стал ученик А.М.Бутлерова – В.В. Марковников.
Сформулированные А.М. Бутлеровым положения легли в основу современной теоретической органической химии.
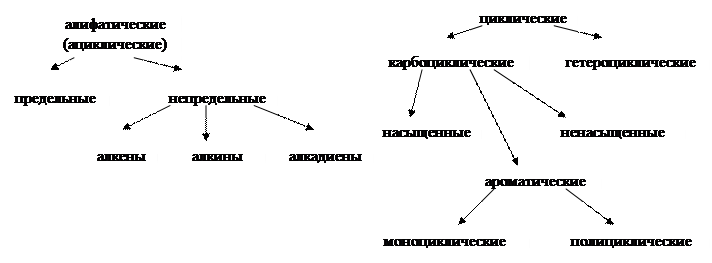
Органические соединения, известные к настоящему времени, могут быть разделены на классы по двум признакам:
1) По типу углеродного скелета молекулы:
 Органические соединения
Органические соединения
 |
2) По типу функциональной группы: галогенопроизводные (–Cl, –Br, –J, –F), гидроксильные производные – спирты и фенолы (–ОН), простые эфиры (–О–), карбонильные соединения – альдегиды и кетоны (–СН=О и >С=О соответственно), карбоновые кислоты (–СООН) и их многочисленные производные, тиолы (–SH), тиоэфиры (–S–), сульфокислоты (–SO2–OH), амины (–NH2 – первичные, –NH– – вторичные, >N – третичные), нитросоединения (–NO2), нитрозосоединения (–N=O), гидразины (–NH–NH2), гидразосоединения (–NH–NH), азосоединения (–N=N–) и множество других азотсодержащих соединений, фосфорорганические соединения, металлорганические соединения.
Кроме монофункциональных соединений существуют многофункциональные соединения, которые в свою очередь могут содержать или несколько однотипных функциональных групп (полифункциональные соединения), или различные группы – соединения со смешанными функциями (гетерофункциональные соединения). Каждый из вышеприведенных классов может классифицироваться на следующих уровнях по другим признакам.
ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ (АЛКАНЫ И ЦИКЛОАЛКАНЫ)
Изучение органической химии начинают с наиболее простых классов соединений, состоящих только из атомов углерода и водорода, и, поэтому относящихся к углеводородам.
Насыщенные соединения (алканы и циклоалканы) – простые органические соединения, состоящие из С и Н, все атомы связаны между собой только одинарными связями, т.е. имеется два типа связей С-С и С-Н. В зависимости от вида углеродной цепи различают: ациклические (парафины – от лат. parum affinis – лишенный сродства) и циклические – циклоалканы, циклопарафины, нафтены. Алканы бывают нормальными (неразветвленными, н-бутан) и разветвленными, циклоалканы – моно-, би- и полициклическими, содержащие и не содержащие боковые цепочки.
Состав алканов СnH2n+2; моноциклоалканов СnH2n, бициклоалканов СnH2n-2. Каждый представитель алканов отличается друг от друга на группу атомов СН2 (метиленовая группа). Такой ряд родственных соединений с однотипной структурой, близкими химическими и однотипно изменяющимися физическими свойствами называется гомологическим, члены этого ряда – гомологами, группа СН2, на которую отличаются члены ряда – гомологической разницей.
По первому представителю алканов – метану (СН4) данные углеводороды называют рядом метана (гомологами метана):
СН3CH3 – этан,
СН3CH2CH3 – пропан,
СН3CH2CH2CH3 – бутан,
СН3CH2CH2CH2CH3 – пентан,
СН3CH2CH2CH2CH2CH3 – гексан,
СН3CH2CH2CH2CH2CH2CH3 – гептан,
СН3CH2CH2CH2CH2CH2CH2CH3 – октан,
СН3CH2CH2CH2CH2CH2CH2CH2CH3 – нонан,
СН3CH2CH2CH2CH2CH2CH2CH2CH2CH3 – декан.
Начиная с С5 – при названии алканов употребляются греческие или латинские числительные.
При составлении названия разветвленного алкана по заместительной номенклатуре выбирается углеродная цепочка, содержащая максимальное число атомов углерода. Цепочка нумеруется таким образом, чтобы заместители, не вошедшие в нее, получили наименьшие номера (локанты) при названии их в алфавитном порядке.
|
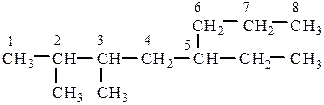
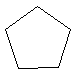
Для циклоалканов перед названием углеводорода (корнем слова) добавляется приставка цикло-:
|
Заместители перечисляются приставками в алфавитном порядке с указанием их локантов.
|
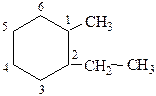
Начиная с С4 в ряду алканов наблюдается изомерия углеродного скелета – структурная изомерия. Изомеры – это соединения с одинаковым качественным и количественным составом и одинаковой молекулярной массой, но различными физическими и химическими свойствами:
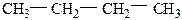
|
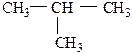
|
С увеличением атомов углерода число изомеров растет. Так, для пентана существует 3 изомера, для декана – 75 изомеров.
Если у одного атома углерода (С*) есть четыре различных заместителя, наблюдается оптическая изомерия:
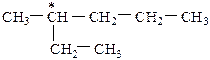
Такой атом углерода С* называется асимметрическим.
Для циклоалканов наблюдается геометрическая или цис-транс-изомерия:
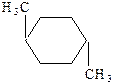
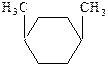
 |
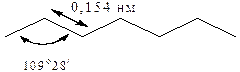 Строение углеродной цепочки алканов можно представить в сокращенном изображении. Например, для гептана:
Строение углеродной цепочки алканов можно представить в сокращенном изображении. Например, для гептана:
СН3СН2СН2СН2СН2СН2СН3
|
На рис. 1 0,154 нм – длина связи С–С; 109о28/ – угол связи.
|
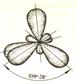 Все атомы углерода в алканах и циклоалканах имеют тип гибридизации sp3, т.е. углерод находится в первом валентном состоянии: в образовании гибридизованных облаков участвует 1s и 3р электрона (рх, ру, рz). Гибридизованные орбитали расположены тетраэдрически, под углом 109о28/. Гибридизованное облако имеет форму несимметричной объемной восьмерки (рис. 2) .
Все атомы углерода в алканах и циклоалканах имеют тип гибридизации sp3, т.е. углерод находится в первом валентном состоянии: в образовании гибридизованных облаков участвует 1s и 3р электрона (рх, ру, рz). Гибридизованные орбитали расположены тетраэдрически, под углом 109о28/. Гибридизованное облако имеет форму несимметричной объемной восьмерки (рис. 2) .
В алканах при образовании связи С–С sp3-гибридизованные орбитали атомов углерода перекрываются друг с другом только в одной плоскости, также как и s-орбиталь атомов водорода связана с гибридизованными орбиталями атомов углерода в связи С–Н:



Такой тип связи называется σ-связью – когда область перекрывания атомных орбиталей лежит на линии, соединяющей центры атомов. σ -связь обладает большой прочностью, т. к. основная масса электронной плотности сосредоточена в небольшом пространстве между ядрами атомов. σ -связь мало полярна и трудно поляризуема. Отсюда следует малая реакционная способность алканов.
Реакционная способность органических соединений зависит от взаимного влияния атомов друг на друга. В σ-связи это влияние характеризует индукционый эффект (I) – эффект, связанный со смещением электронной плотности вдоль σ-связи, которое вызвано разностью электроотрицательностей атомов, входящих в соединение:
Например, в соединении Н2 атомы водорода имеют одинаковую электроотрицательность. Если вместо водорода в состав соединения входят другие атомы, то возможны 2 случая индуктивного эффекта: отрицательный индукционный эффект (–I) и положительный индукционный эффект (+I).
|  | |||
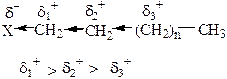
где Х – электроноакцепторный заместитель: NO2, CN, OH, F, Cl, Br, C6H5, CH2=CH–.
|  | |||
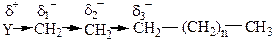
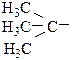

 где Y – электронодонорный заместитель: металлы,
где Y – электронодонорный заместитель: металлы,
СН3–СН2–, СН3–.
Из-за малой поляризуемости σ-связи индукционный эффект быстро затухает в насыщенных соединениях (практически не проявляется на третьей связи).
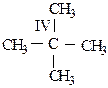 Углеводородные цепочки алканов могут содержать следующие виды атомов углерода: первичный, вторичный, третичный и четвертичный.
Углеводородные цепочки алканов могут содержать следующие виды атомов углерода: первичный, вторичный, третичный и четвертичный.
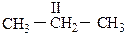
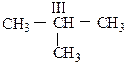
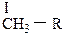
СI – первичный углеродный атом, связанный только с одним соседним углеродным атомом;
СII – вторичный, связанный с двумя соседними углеродами;
СIII – третичный, связанный с тремя соседними углеродными атомами;
СIV – четвертичный, связанный с четырьмя соседними углеродами.
Реакционная способность углеродных атомов (легкость образования свободных радикалов и карбкатионов) уменьшается в ряду: третичный > вторичный > первичный, т. к. на его диссоциацию (ионизацию) требуется затратить больше энергии.
| <== предыдущая страница | | | следующая страница ==> |
| | | Способы получения |
Дата добавления: 2014-04-15; просмотров: 982; Нарушение авторских прав

Мы поможем в написании ваших работ!