
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Способы получения
Способы получения алканов можно разделить на следующие группы:
I.Промышленные способы.
Выделение из природных источников: природного и попутного газа, нефти, каменного угля, сланцев. В зависимости от месторождения того или иного полезного ископаемого, состав алканов сильно колеблется. Природный газ состоит, в основном, из метана (97-98 %); в некоторых месторождениях встречаются его гомологи с числом углеродных атомов С3–С5. Нефть состоит из смеси алканов, начиная с С5 (пентаны) до высших, содержащих несколько десятков атомов углерода, а также примесей циклоалканов и ароматических углеводородов.
II.Лабораторные способы получения.
1) Из синтез-газа:

2) Реакция Вюрца (действие металлического Na на галогенопроизводные). Общая схема:
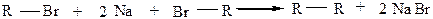
Лучше всего по реакции Вюрца получать симметричные углеводороды, например:
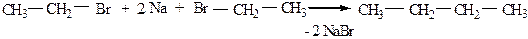
Если используются галогенопроизводные с разным числом атомов углерода в цепочке, то образуется смесь алканов:
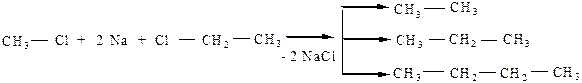
Реакционная способность галогенопроизводных убывает в ряду: R–I > R–Br > R–Cl.
3) Реакция Кольбе (электролиз солей карбоновых кислот) используется для получения алканов с четным числом атомов углерода в молекуле:
|
|
|
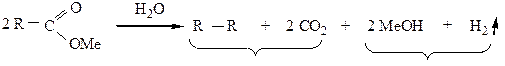
|
|
|
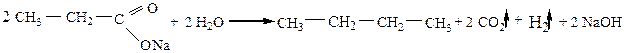
4) Декарбоксилирование солей карбоновых кислот (сплавление солей карбоновых кислот со щелочами):

|
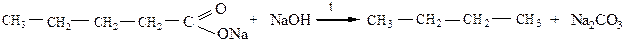
|
В результате получаются алканы с длиной углеродной цепи меньше на один атом углерода, чем в исходном соединении.
5) Реакция восстановления может использоваться для получения алканов из непредельных соединений с тем же числом атомов углерода в исходной молекуле действием на них водорода в присутствии катализаторов:
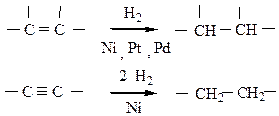
Ni, Pt, Pd – катализаторы реакции гидрирования кратных связей.
|
|
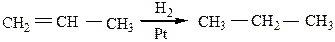
|
|
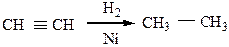
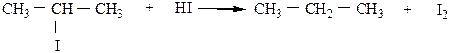
6) Восстановление галогенопроизводных предельных углеводородов может быть проведено водородом в момент выделения (при взаимодействии металла с кислотой), либо HJ при нагревании в случае йодпроизводных.
|
|
|
|
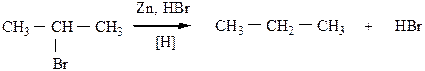
Физические свойства.
Алканы с числом углеродных атомов в цепочке С1–С4 – газы, С5–С16 – жидкости; с С17 – твердые вещества.
Для нормальных алканов по мере роста молекулярной массы (Мr) увеличиваются температура плавления (tпл,), температура кипения (tкип), плотность (ρ). Алканы с разветвленной цепью кипят при более низких температурах, чем нормальные алканы. Чем сильнее разветвлен алкан, тем ниже его температура кипения. Температура кипения циклоалканов несколько выше, чем у соответствующих алканов.
Все алканы легче воды, их плотность ρ < 0,8 г/см3. Они практически нерастворимы в воде, но хорошо растворяются в органических растворителях. Метан, этан и высшие гомологи не имеют запаха. Средние гомологи имеют запах бензина.
| <== предыдущая страница | | | следующая страница ==> |
| ТЕОРЕТИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ ОРГАНИЧЕСКОЙ ХИМИИ | | | ХИМИЧЕСКИЕ СВОЙСТВА |
Дата добавления: 2014-04-15; просмотров: 884; Нарушение авторских прав

Мы поможем в написании ваших работ!