
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ХИМИЧЕСКИЕ СВОЙСТВА
Так как в молекулах алканов содержится только σ-связь, которая трудно поляризуется и практически неполярна, для алканов характерны реакции, идущие по радикальному типу – реакции замещения (SR). Реакции присоединения не характерны, поскольку все связи в молекулах алканов насыщены.
Наиболее легко замещается водород у третичного углеродного атома, труднее – у вторичного, еще труднее – у первичного, затем – у метильного. Наиболее характерно эта закономерность проявляется, если реакция проводится при максимально возмодной температуре.
1) Галогенирование.
Активность галогенов убывает в ряду F2>Cl2>Br2>I2.
Со фтором реакция идет со взрывом, с йодом реакция не идет из-за обратимости процесса. Для получения фторпроизвоных используют реакцию с CoF3:
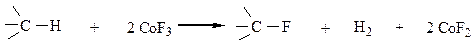
Галогенирование алканов протекает на свету, при нагревании (250-400 оС) или в присутствии катализаторов (хлориды меди, олова, сурьмы).
С хлором реакция идет более энергично, но менее избирательно. Механизм реакции радикально-цепной:
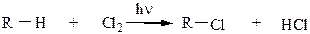
|
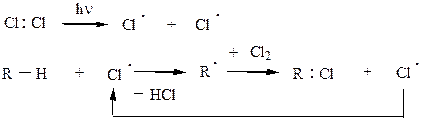
Обрыв цепи:
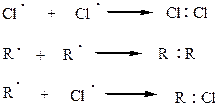
С бромом реакция идет менее энергично, но более избирательно.
|
|
|
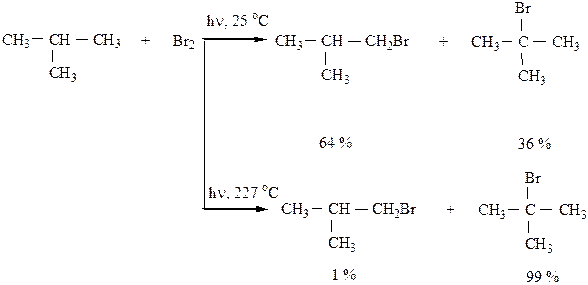
2) Нитрование по Коновалову проводится действием разбавленной азотной кислоты HNO3 (13-15 %), давлении и температуры t=100-150 оС. Легче всего водород замещается у третичного углеродного атома. Механизм реакции – радикального замещения (SR).
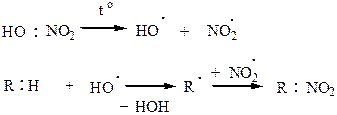
При повышенной температуре концентрированная азотная кислота окисляет алканы до карбоновых кислот.
3) Сульфирование алканов проводится только олеумом, реакция идет по вторичному или первичному углеродному атому, по третичному не идет из-за пространственных затруднений.
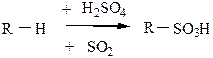
4) Сульфохлорирование проводится на свету при комнатной температуре. При этом через жидкие алканы барботируется смесь газов SO2 и Cl2. Преимущественно, из-за большого объема группы SO2Cl получаются вторичные алкансульфохлориды. Труднее замещается водород у первичного атома углерода и практически не участвует в реакции третичный углеродный атом из-за пространственных затруднений. Механизм реакции SR.
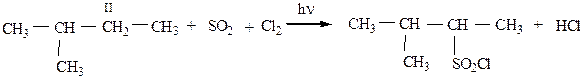
|
5) Сульфоокисление – действие смеси SO2 + O2 в присутствии перекисей, реакция протекает также, преимущественно у вторичных углеродных атомов по механизму SR.
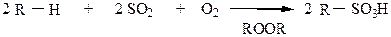
|
|
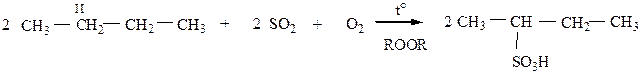
6) Окисление.
Полное окисление – горение (окисление кислородом воздуха при повышенной температуре) выражается суммарным уравнением:
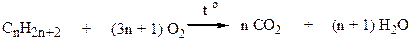
Неполное окисление (окисление при tср или в газообразной фазе чистым кислородом – аутоокисление) в присутствии MnO2 позволяет получить спирты, альдегиды, кетоны или кислоты.
|
|
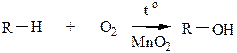
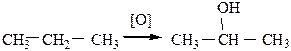
|
|
Неполное окисление – цепной радикальный процесс с вырожденным разветвлением.
|
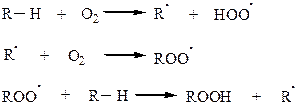
Алкилгидроперекись частично распадается, инициируя новую цепь
|
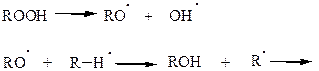
Для получения необходимых соединений подбираются соответствующие условия.
7) Термическое разложение.
При действии на алканы повышенной температуры может происходить либо крекинг, либо пиролиз углеводородов.
Крекинг бывает термический (при t=500-600 oC) и каталитический (при t=400-500 oC в присутствии катализаторов). При температуре более 700 оС происходит пиролиз.
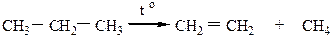
|
|
Исходная молекула может распадаться по любой связи С-С или С-Н с образованием радикала, который потом претерпевает дальнейшие превращения с образованием разнообразных продуктов (алканов, алкенов, алкинов) с меньшим числом атомов углерода (алкины) или с тем же числом атомов углерода (появляются кратные связи). При этом должно соблюдаться правило:
ΣСисх=ΣСкон
ΣСисх – количество атомов углерода в исходном соединении
ΣСкон – суммарное количество атомов углерода в конечных продуктах
УГЛЕВОДОРОДЫ С ДВОЙНЫМИ СВЯЗЯМИ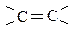 АЛКЕНЫ
АЛКЕНЫ
Углеводороды, содержащие в своих молекулах двойную связь являются ненасыщенными соединениями и называются алкенами. Старое название соединений этого ряда – олефины, т.к. соединение хлора с этиленом образует маслянистое вещество (oleum – «масло»). Общая формула алкенов СnH2n.
Гомологический ряд начинается с С2Н4 – этилена, поэтому углеводороды этого класса также называются этиленовыми. СН2=СН–СН3 – пропилен и т.д., т.е. при составлении названия добавляется суффикс «–ен».
Радикалы: СН2–СН=СН– 1-пропенил
СН3–СН=СН–СН2– 2-бутенил, т.е. при составлении названия радикалам присваивается суффикс «–енил».
Сохранились тривиальные названия радикалов: СН2=СН– винил, СН2=СН–СН2– аллил.
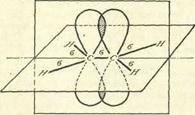 Атомы углерода находятся во 2-ом валентном состоянии. Тип гибридизации sp2. Гибридизованные орбитали, образующие σ-связь, лежат в одной плоскости, негибридизованные р-облака, имеющие форму объемной восьмерки, от каждого атома углерода перекрываются друг с другом над и под плоскостью sp2-гибридизованных облаков (σ-связи), образуя π-связь (рис. 3).
Атомы углерода находятся во 2-ом валентном состоянии. Тип гибридизации sp2. Гибридизованные орбитали, образующие σ-связь, лежат в одной плоскости, негибридизованные р-облака, имеющие форму объемной восьмерки, от каждого атома углерода перекрываются друг с другом над и под плоскостью sp2-гибридизованных облаков (σ-связи), образуя π-связь (рис. 3).
Рис. 3
Энергия σ-связи – 341 кДж/моль, а энергия π-связи – 269,8 кДж/моль, поэтому она легче разрывается, вследствие чего алкены являются более реакционноспособными соединениями, чем алканы, и способны вступать в реакции присоединения по кратной связи.
π-связь, в отличие от σ-связи, легко поляризуется, поэтому для алкенов, в основном, реакции присоединения идут преимущественно по электрофильному механизму.
Наряду со структурной и пространственной изомерией появляется изомерия по положению двойной связи:
СН3–СН=СН–СН3 2-бутен
СН2=СН–СН2–СН3 1-бутен,
а также еще один вид изомерии – геометрическая (цис-транс-изомерия), являющаяся частным случаем пространственной изомерии:
|
|

Изомеры различаются расположением заместителей у ненасыщенных атомов углерода относительно плоскости двойной связи, а также физическими и некоторыми химическими свойствами.
СПОСОБЫ ПОЛУЧЕНИЯ
В природе алкены встречаются в небольшом количестве, в промышленности их получают при переработке нефти, природного и попутных газов. Основные лабораторные способы получения следующие:
1) Крекинг алканов осуществляется при t=400-550 оС и давлении р=3·105 – 70·105 Па, пиролиз – при t=700-800 оС, в результате чего удается получить алкены с длиной углеродной цепочки С2-С5 до 35 % в смеси с другими углеводородами.
2) Дегидрирование предельных углеводородов протекает при нагревании в присутствии катализаторов
|
|
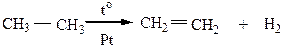
Катализаторами в этой реакции могут быть Ni, Pt, Pd. При использовании Ni требуется повышенная температура.
3) Дегидратация спиртов происходит при нагревании в присутствии водоотнимающих средств (H2SO4, H3PO4 или Al2O3)по правилу Зайцева: если имеется два (или три) направления реакции отщепления молекулы Н-А, то атом водорода преимущественно уходит от соседнего наименее гидрогенизированного атома углерода.
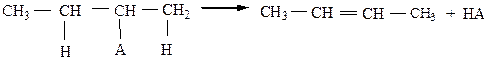
|
|
|
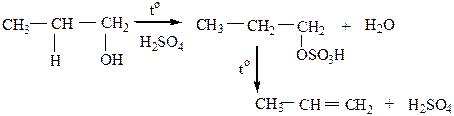
Легче всего группа –ОН отщепляется от третичного, затем от вторичного, и труднее – от первичного атома углерода.
4) Из галогенопроизводных
а) дегидрогалогенирование протекает под действием твердых щелочей (KOH, NaOH) или их спиртовых растворов согласно правилу Зайцева:
|
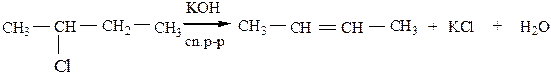
Реакционная способность галогенопроизводных убывает в ряду: третичные > вторичные > первичные.
б) из вицинальных дигалогенопроизводных алкены получаются при действии Zn либо Mg, при этом отщепляются сразу оба атома галогена:
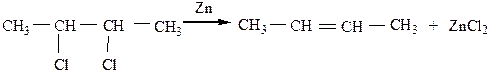
5) Восстановление более непредельных углеводородов (ацетиленовых) идет в присутствии тех же катализаторов, что и реакция дегидрирования (Ni, Pt или Pd)
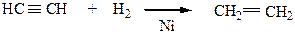
Физические свойства.
Алкены состава С2 – С4 – газы, С5 – С17 – жидкости, С18 и более – твердые вещества.
Нормальные алкены обладают более высокой tкип по сравнению с изомерами разветвленного строения. Все алкены малорастворимы в воде. Плотность ρ<1. С увеличением Mr увеличивается tкип, tпл и ρ. Алкены малополярны, но легко поляризуются, так как имеют в составе молекул π-связь.
ХИМИЧЕСКИЕ СВОЙСТВА
Для алкенов характерны реакции присоединения, окисления и полимеризации.
При протекании реакций присоединения разрывается только π-связь, реагент присоединяется по механизму электрофильного присоединения (АЕ) к обоим углеродным атомам по двойной связи.
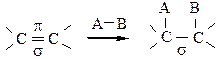
1) Гидрирование – присоединение водорода по двойной связи; приводит к образованию насыщенных соединений (алканов) с той же длиной углеродной цепочки, что и в исходном соединении. Реакция идет в присутствии катализаторов: Ni, Pt или Pd.
|
|
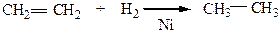
Реакционная способность падает в ряду: R2C=CR2 > R2C=CHR > CH2=CR2 > RCH=CHR > CH2=RCH > CH2=CH2.
2) Галогенирование протекает легко в растворителе, в темноте, при комнатной температуре. Присоединение Br2 в ССl4 (к алкенам) является качественной реакцией на двойную связь, т.к. в результате ее бромная вода обесцвечивается.
|
|
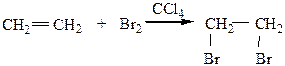
Br2 + CCl4 – бромная вода.
Механизм реакции бромирования АЕ:
|
|
|
|
|
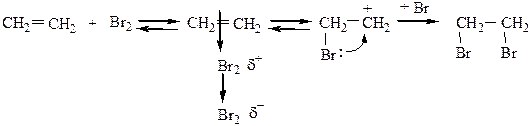
3) Присоединение галогеноводородов происходит по правилу Марковникова: реагент А-В, распадающийся на положительно и отрицательно заряженные частицы, присоединяется к кратной связи таким образом, что положительно заряженная частица присоединяется к наиболее гидрогенизированному, а отрицательно заряженная – к наименее гидрогенизированному атому углерода кратной связи
|
|
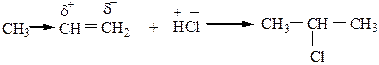
Механизм реакции АЕ:
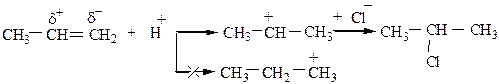
В первом случае образуется вторичный карбкатион, который более устойчив. Во втором случае образуется менее устойчивый первичный карбкатион, поэтому дальнейшее протекание реакции затруднено.
Устойчивость (легкость образования) карбкатионов падает в ряду:
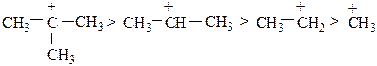
Реакционная способность галогенопроизводных и селективность процесса уменьшается в ряду: HBr > HCl > HF.
Для HBr реакция в присутствии Н2О2 протекает против правила Марковникова. Наблюдается так называемый «прекисный эффект» или эффект Хараша, т.к. идет по механизму радикального присоединения Ar:
|
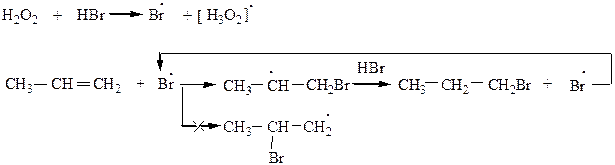
В первом случае образуется более устойчивый вторичный радикал, который вступает во взаимодействие с HBr с образованием галогенопроизводного. Первичный радикал менее устойчив.
4) Гидратация (присоединение воды) протекает по правилу Марковникова в присутствии катализаторов – H3PO4, Al2O3 при повышенной температуре
|
|
|
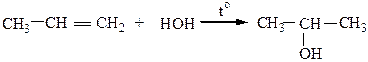
Механизм реакции АЕ:
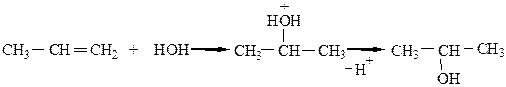
5) Присоединение серной кислоты протекает (по правилу Марковникова) при смешивании алкена с H2SO4:
|
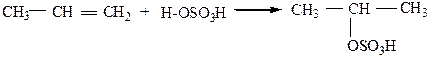
6) Образование галогенгидринов идет при взаимодействии Cl2 или Br2 с алкенами в присутствии воды (по правилу Марковникова):
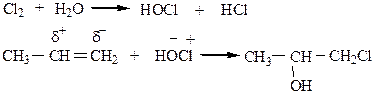
7) Реакции окисления протекают по месту разрыва двойной связи. При действии слабых окислителей рвется только одна π-связь, сильных – обе связи (δ- и π-связь).
|
|
|
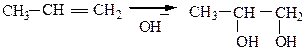
б) Окисление сильными окислителями. При действии сильных окислителей (концентрированных кислот при нагревании, KMnO4 конц. при to или K2Cr2O7 в присутствии H2SO4) образуются альдегиды или кетоны, в зависимости от строения алкена, которые в дальнейшем окисляются до карбоновых кислот:
|
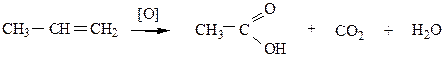
|
|
|
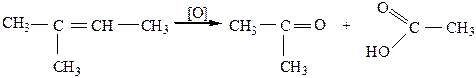
|
в) Окисление кислородом воздуха в присутствии серебра приводит к образованию окисей олефинов.
|
|
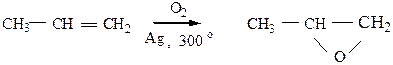
г) Окисление надкислотами. При взаимодействии алкенов с надкислотами образуются эпоксиды по реакции Прилежаева
|
|
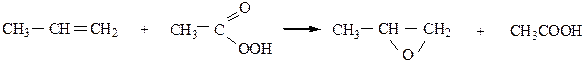
г) Реакция озонирования(озонолиз) – реакция Гарриеса – происходит при взаимодействии алкена с О3. По продуктам реакции можно определить строение исходного алкена:

|
|
Образовавшийся озонид (неустойчивое, легко взрывающееся вещество) обрабатывают водой в присутствии восстановителя для разложения выделяющейся Н2О2
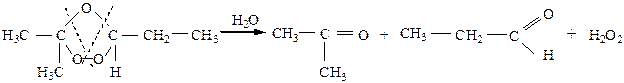
|
|
| ||||||
|
|
|
|
|
|
9) Реакция замещения водорода на Cl происходит при высокотемпературном хлорировании алкенов (t=500 oC). Замещение происходит в аллильном (α-) положении относительно двойной связи. Механизм реакции SR.
|
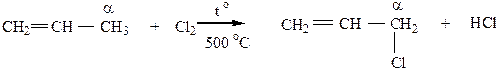
|
|
|
|
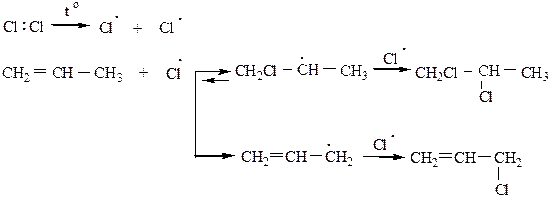
Вторичный радикал крайне неустойчив при 500 оС и очень быстро распадается. Первичный радикал обладает повышенной устойчивостью вследствие мезомерного эффекта (эффекта сопряжения), именно он реагинрует с Cl2 с образованием аллилхлорида. Легкость замещения водорода в радикалах можно расположить в следущий ряд: аллильный > третичный > вторичный > первичный > СН3. > винильный.
| <== предыдущая страница | | | следующая страница ==> |
| Способы получения | | | ДИЕНОВЫЕ УГЛЕВОДОРОДЫ |
Дата добавления: 2014-04-15; просмотров: 2137; Нарушение авторских прав

Мы поможем в написании ваших работ!