
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Физические свойства. Фенолы и нафтолы – кристаллические вещества, труднорастворимые в воде
Фенолы и нафтолы – кристаллические вещества, труднорастворимые в воде. Обладают специфическим запахом, более высокими tкип и ρ по сравнению со спиртами. Очень токсичны.
ХИМИЧЕСКИЕ СВОЙСТВА
Химические свойства фенолов обусловлены наличием гидроксигруппы и ароматического ядра. Фенолы – более сильные кислоты, чем спирты, способны вступать в реакцию со щелочами и даже Na2CO3, т.к. неподеленная электронная пара атома кислорода вступает во взаимодействие с бензольным ядром (+М),
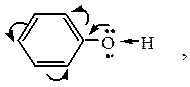
атом водорода может легко отщепляться в виде Н+.
1) Образование фенолятов происходит при взаимодействии с Na, K или щелочами (NaOH, KOH):
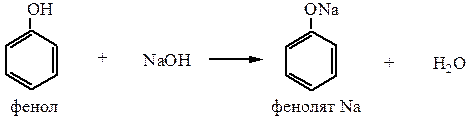
2) Взаимодействие с FeCl3 – качественная реакция на фенолы, образуются интенсивно окрашенные комплексные соединения:
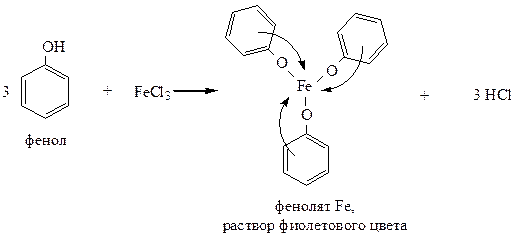
3) Образование простых эфиров происходит в присутствии водных растворов щелочей при нагревании. Образуется фенолят Na, действием на который галогенопроизводных, диметилсульфата и некоторых др. реагентов можно получить простые эфиры фенола.
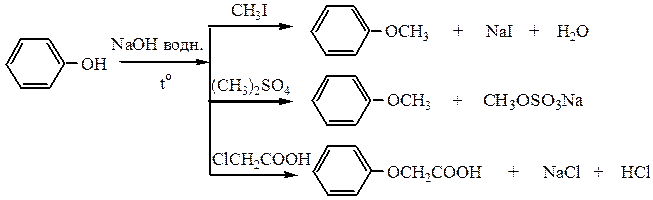
4) Образование сложных эфиров – при взаимодействии с хлорангидридами и ангидридами кислот:
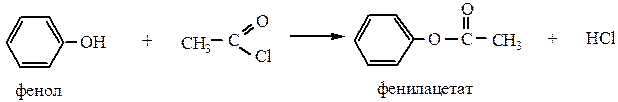
Для фенолов затруднены реакции, связанные с заменой группы –ОН.
5) Восстановление фенолов происходит водородом при 150 оС и р=20·105Па над катализатором Ni/Al2O3. В результате получаются циклические спирты:

6) Окисление фенолов протекает очень легко. Даже при стоянии при tкомн. фенолы быстро темнеют, поглощая кислород воздуха. Легкая окисляемость позволяет использовать пространственно затрудненные фенолы в качестве антиоксидантов в пищевой промышленности (для сохранения свойств жиров, масел, кондитерских изделий, концентратов, рыбы, мяса и т.д.) и химической промышленности (замедление старения каучука).
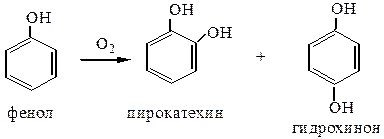

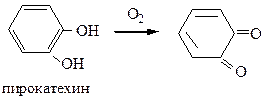
7) Реакции углеводородного радикала. Взаимное влияние группы –ОН и ароматического ядра сильно активирует реакции электрофильного замещения, которые протекают в о- или п-положение по отношению к гидроксилу.
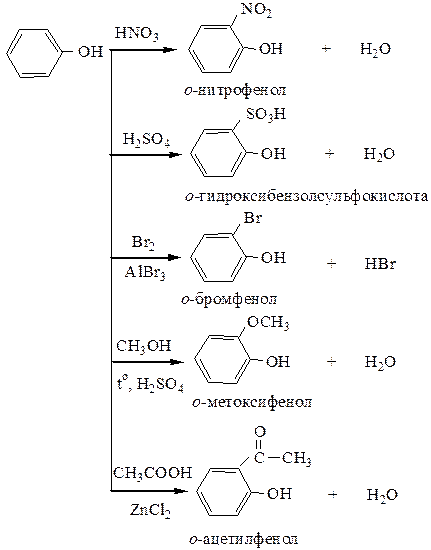
Имея сильно активированное ядро, фенолы вступают во взаимодействие даже со слабыми электрофилами, например, с азотистой кислотой:
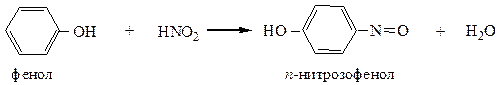
ОКСОСОЕДИНЕНИЯ. АЛЬДЕГИДЫ И КЕТОНЫ.
Альдегидами называются карбонильные соединения, содержащие в своем составе группу 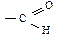 , где углерод связан с углеводородным радикалом; кетоны – карбонильные соединения, имеющие группу
, где углерод связан с углеводородным радикалом; кетоны – карбонильные соединения, имеющие группу  , где углерод связан с двумя углеводородными радикалами. В зависимости от вида радикала бывают предельные, непредельные, циклические, ароматические, гетероциклические карбонильные соединения. По количеству карбонильных групп различают моно-, ди- и поликарбонильные соединения.
, где углерод связан с двумя углеводородными радикалами. В зависимости от вида радикала бывают предельные, непредельные, циклические, ароматические, гетероциклические карбонильные соединения. По количеству карбонильных групп различают моно-, ди- и поликарбонильные соединения.
При составлении названия альдегидов к корню слова добавляется суффикс –аль, кетонов – суффикс –он с указанием его локанта.
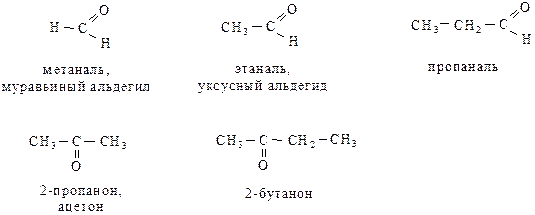
Изомерия оксосоединений определяется строением углеводородных радикалов и положением карбонильной группы.
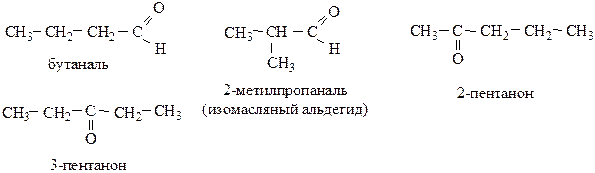
СПОСОБЫ ПОЛУЧЕНИЯ
1) Окисление спиртов (было рассмотрено ранее).
2) Дегидрирование спиртов (было рассмотрено выше).
3) Восстановление галогенангидридов карбоновых кислот по Розенмунду водородом над катализаторами. В качестве катализаторов используют Pd, нанесенный на BaSO4.
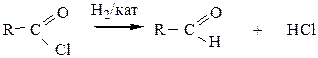
4) Окисление ароматических углеводородов, содержащих метильную группу в боковой цепи. Способ используется для получения ароматических альдегидов.
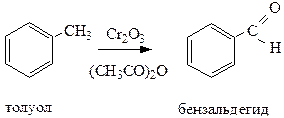
5) Разложение Ca и Ba солей карбоновых кислот при сухой перегонке. Если хотя бы один кислотный остаток является остатком муравьиной кислоты, то получаются альдегиды, если в состав соли входят остатки других карбоновых кислот – кетоны.
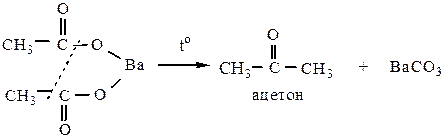
6) Гидролиз геминальных галогенопроизводных происходит при действии водных растворов щелочей. Промежуточный геминальный диол неустойчив по правилу Эрленмейера, в результате чего происходит внутримолекулярная дегидратация с образованием оксосоединений.
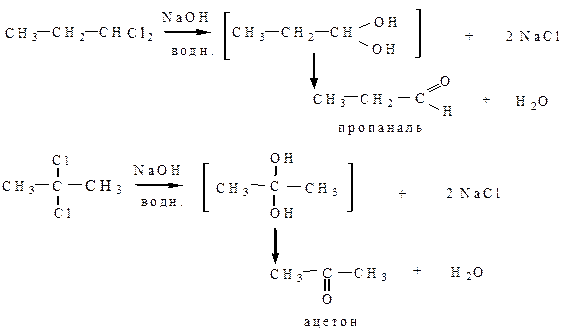
7) Реакция Кучерова (присоединение воды к алкинам – рассмотрена ранее).
8) Оксосинтез – присоединение СО и Н2 а алкенам в присутствии Ni или Со при 100-200 оС и р=(100-253)·105 Па.
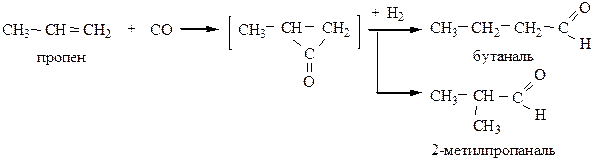
Способ характерен только для получения альдегидов.
9) Получение ароматических кетонов по реакции Фриделя-Крафтса (ацилирование бензола и его гомологов) – рассмотрено ранее.
10) Реакция Гаттермана-Коха – является способом получения ароматических альдегидов.
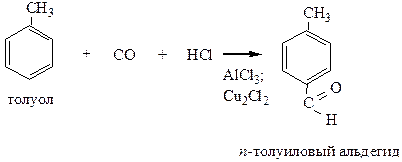
Дата добавления: 2014-04-15; просмотров: 876; Нарушение авторских прав

Мы поможем в написании ваших работ!