
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
СПОСОБЫ ПОЛУЧЕНИЯ
1) Окисление алканов, алкенов, алкинов, спиртов, альдегидов, кетонов – было рассмотрено ранее.
2) Оксосинтез – взаимодействие алкенов с СО и H2O:
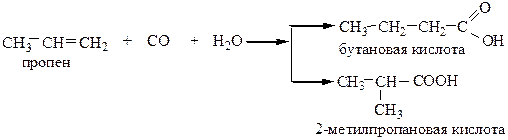
Реакцию ведут при t=50-100 oC, p=10·105 Па, катализаторы – сильные кислоты H2SO4 и H3PO4.
3) Гидролиз нитрилов.
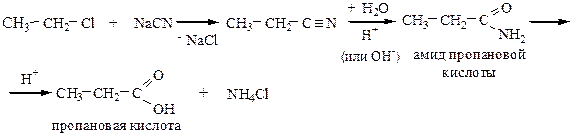
Реакцию ведут при нагревании с водными растворами щелочей или кислот.
4) Гидролиз геминальных тригалогенопроизводных
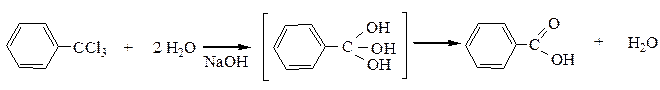
5) Металлорганический синтез позволяет получить из галогенопроизводных кислоты любых классов:
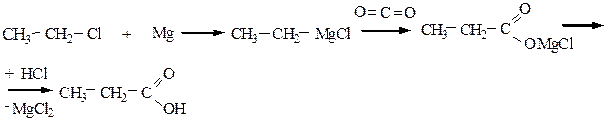
Кроме Mg, возможно использование Li или Al.
6) Гидролиз сложных эфиров. В основном используется для получения высших карбоновых кислот (С14–С22) из триглицеридов (жиров):
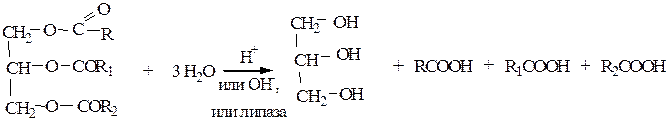
7) Декарбоксилирование (отщепление карбоксильной группы) двухосновных кислот. Реакция идет при нагревании до t=140-150 oC.
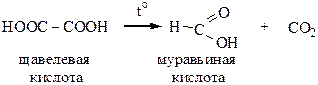
8) Синтезы с помощью малонового эфира. Диэтиловый эфир малоновой кислоты способен вступать в реакцию с этилатом Na, при этом происходит замещение водорода в α-положении (у центрального атома углерода) на натрий:
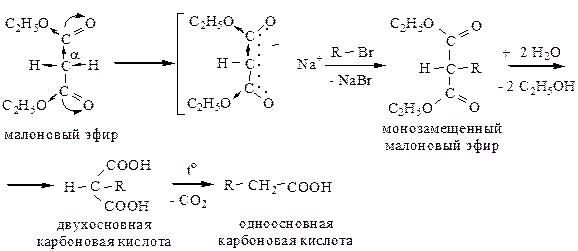
Второй атом водорода в α-положении малонового эфира также можно постадийно заместить с образованием дизамещенного эфира. Малоновый эфир вносит в синтезируемую кислоту остаток уксусной кислоты, вся остальная часть молекулы вносится галогенопроизводными.
Физические свойства.
Первые 3 кислоты (С1–С3) – жидкости с резким запахом, начиная с С4 (масляная кислота) – маслянистые жидкости с неприятным запахом; с С10 – твердые вещества без цвета и запаха. Низкомолекулярные кислоты хорошо растворимы в воде, с увеличением молекулярной массы растворимость кислот уменьшается. tкип. и tпл. в гомологическом ряду имеют обычные, ранее рассмотренные закономерности. По сравнению с остальными классами органических соединений, карбоновые кислоты имеют более высокие tкип. и tпл. из-за их способности образовывать линейные и циклические ассоциаты за счет водородных связей:

ХИМИЧЕСКИЕ СВОЙСТВА
Химические свойства карбоновых кислот обусловлены наличием карбоксильной группы и строением углеводородного радикала.
Электронное строение карбоксильной группы таково, что карбонильный кислород 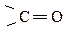 сильно смещает плотность π-связи в свою сторону. У атома углерода создается недостаток электронной плотности, и он, в свою очередь, смещает к себе плотность от кислорода группы –ОН, а тот – плотность атома водорода из гидроксила. Этот водород становится подвижным и легко отщепляется в виде протона Н+.
сильно смещает плотность π-связи в свою сторону. У атома углерода создается недостаток электронной плотности, и он, в свою очередь, смещает к себе плотность от кислорода группы –ОН, а тот – плотность атома водорода из гидроксила. Этот водород становится подвижным и легко отщепляется в виде протона Н+.
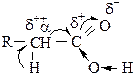
Водород, стоящий в α-положении по отношению к карбоксильной группе из-за смещения электронной плотности к карбонильному кислороду также подвижен и может быть замещен под действием определенных реагентов.
В водном растворе карбоновые кислоты диссоциируют с образованием карбоксилат-аниона и иона гидроксония:
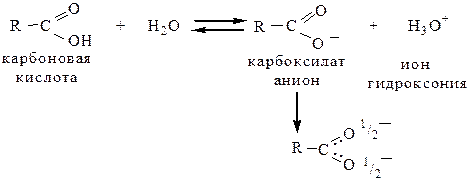
В образовавшемся карбоксилат-анионе заряд делокализуется, и электронная плотность равномерно распределяется между обоими атомами кислорода (образуется мезомерный ион).
Степень диссоциации одноосновных кислот (за исключением муравьиной) невелика (рКа ≈ 4,7-5) и зависит от строения радикала, связанного с карбоксильной группой. Алкильные радикалы, обладающие +I-эффектом снижают кислотность; электроноакцепторные группы (–I-эффект) повышают:
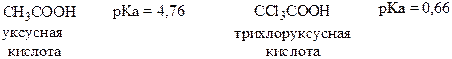
Карбоновые кислоты могут проявлять свои кислотные свойства с образованием солей; отщеплять группу –ОН с образованием разнообразных функциональных производных карбоновых кислот, а также восстанавливаться до альдегидов или спиртов и декарбоксилироваться. В химические реакции также может вступать радикал карбоновой кислоты.
1. Кислотные свойства карбоновых кислот. Образование солей.
При взаимодействии с металлами, гидроксидами металлов, оксидами и карбонатами, а также аммиаком карбоновые кислоты дают соответствующие соли.

Соли карбоновых кислот легко гидролизуются с образованием исходных кислот.
2. Образование сложных эфиров (реакция этерификации). При взаимодействии карбоновых кислот со спиртами в присутствии сильных минеральных кислот образуются сложные эфиры. Реакция обратима.
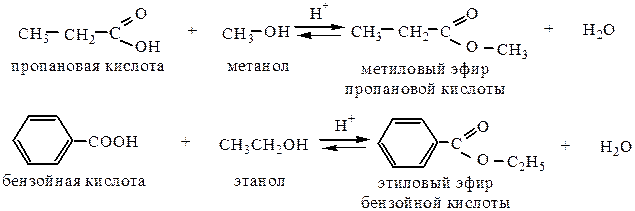
Скорость реакции зависит от строения спирта и силы кислоты и уменьшается с увеличением размеров углеводородных радикалов.
3. Образование ангидридов происходит при нагревании кислот в присутствии сильных водоотнимающих средств (кроме муравьиной кислоты, т.к. она разлагается на СО2 и Н2О).
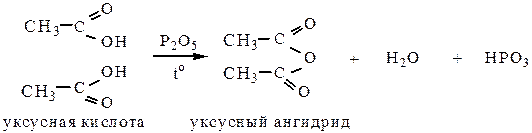
4. Образование хлорангидридов происходит при действии на кислоты PCl3, PCl5 или SOCl2.
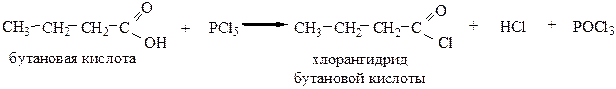
Галогенангидрид муравьиной кислоты получить невозможно, т.к. она разлагается на СО и НСl.
5. Восстановление карбоновых кислот (под действием LiAlH4; либо действием Na в спирте) позволяет получить альдегиды или спирты в зависимости от условий реакции.
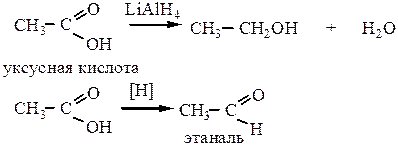
6. Реакции углеводородного радикала.
6.1 Галогенирование алифатических кислот в α-положение
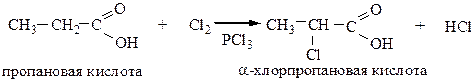
Реакция протекает как с Cl2, так и с Br2 по ионному механизму.
6.2 Окисление карбоновых кислот. В биологических системах под действием ферментов (оксидазы) окисляется β-углеродный атом:
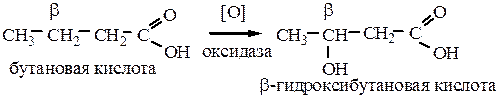
Если в α-положении карбоновой кислоты есть третичный атом углерода, то окислению подвергается он:
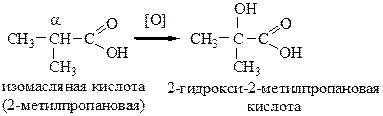
6.3 Замещение атома водорода в ароматических кислотах. Ароматические кислоты вступают во все реакции электрофильного замещения, характерные для гомологов бензола (группа СООН – заместитель II-рода, ориентирует в м-положение электрофильные реагенты):
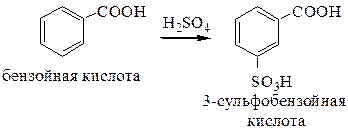
7. Декарбоксилирование карбоновых кислот протекает в жестких условиях при повышенных температурах. Реакция облегчается при использовании солей карбоновых кислот (рассмотрено ранее как способ получения алканов).

ОДНООСНОВНЫЕ НЕНАСЫЩЕННЫЕ КИСЛОТЫ
Если в молекуле карбоновой кислоты имеется одна или несколько связей 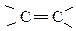 или
или 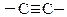 , то такие кислоты являются ненасыщенными:
, то такие кислоты являются ненасыщенными:
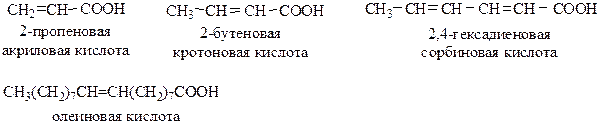
Структурная изомерия одноосновных ненасыщенных кислот связана со строением углеродного скелета и положением двойной связи. Для ненасыщенных кислот существует пространственная изомерия (цис- и транс-):
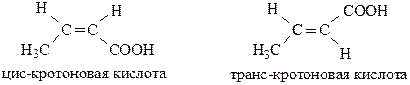
СПОСОБЫ ПОЛУЧЕНИЯ
Для получения ненасыщенных кислот обычно используют соединение, уже содержащее одну из функциональных групп (карбоксильную группу или двойную связь).
1) Высшие карбоновые кислоты (содержащие от 12 до 22 атомов углерода), получают гидролизом жиров (липидов). Метод был рассмотрен ранее.
2) Из α-галогенкарбоновых кислот. Кратная связь образуется под действием спиртовых растворов щелочей или твердой щелочи.
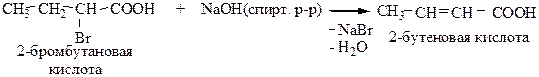
3) Дегалогенирование дигалогенозамещенных карбоновых кислот, содержащих галогены у соседних атомов углерода. Образование кратной связи происходит под действием цинковой пыли.
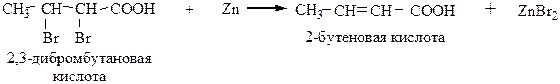
4) Дегидратация β-гидроксикислот (при нагревании они легко отщепляют воду с образованием двойной связи):
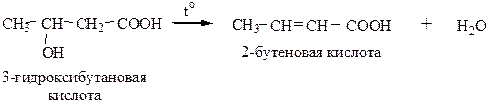
5) Окисление непредельных альдегидов:
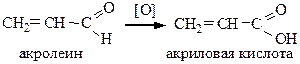
6) Получение непредельных карбоновых кислот из алкенов:
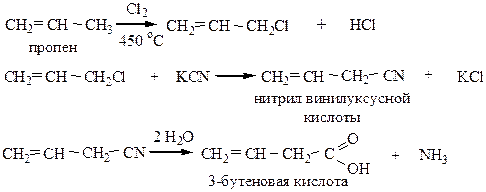
| <== предыдущая страница | | | следующая страница ==> |
| Применение. Формальдегид используется для синтеза разнообразных органических веществ, при производстве полимерных материалов | | |
Дата добавления: 2014-04-15; просмотров: 1130; Нарушение авторских прав

Мы поможем в написании ваших работ!