
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Важнейшие окислители и восстановители
К числу сильных окислителей, широко используемых на практике, относятся галогены (Fe2, Cl2, Br2, I2), оксид марганца Mn+4O2, перманганат калия KMn+7O4, манганат калия K2Mn+6O4, оксид хрома (хромовый ангидрид) Cr+6O3, хромат калия K2Cr+6O4, бихромат калия K2Cr2+6O7, азотная кислота HN+5O3 и ее соли, кислород О2, озон О3, перекись водорода Н2О2, концентрированная серная кислота Н2S+6О4, оксид меди (II) Сu+2О, оксид серебра Ag2+1O, оксид свинца Рb+4О2, гипохлориты (например, NaCl-1O) и другие соединения.
Щелочные и щелочноземельные металлы являются сильными восстановителями. К числу других восстановителей относятся: водород, углерод, оксид углерода С+2О, сероводород Н2S-2, оксид серы S+4О2, сернистая кислота Н2S+4О3 и ее соли, галогенводороды (кроме HF), хлорид олова (II) Sn+2Cl2, сульфат железа (II) Fe+2SO4.
Типы окислительно-восстановительных реакций. Окислительно–восстановительный эквивалент
Различают три типа окислительно–восстановительных реакций: межмолекулярные, внутримолекулярные и реакции самоокисления–самовосстановления.
A. Межмолекулярные – это такие реакции, в которых молекулы, атомы или ионы элементов, входящие в состав одного вещества и являющиеся окислителем, взаимодействуют с молекулами, ионами, атомами, входящих в состав другого вещества (восстановителя): например:
Mn+4O2 + 4HCl-1 = Mn2+Cl2 + Cl20 + 2H2O.
B. Во внутримолекулярных реакциях изменяется СО элементов одного и того же вещества таким образом, что одни из них окисляются, а другие - восстанавливаются. К таким реакциям относится, например, разложение бертолетовой соли и оксида ртути (II):
2KCl+5O3-2 = 2KCl-1 + 3O20;
2Hg+2O-2 = 2Hg0 + O20.
C. В реакциях самоокисления–самовосстановления (диспропорционирования) атомы одного и того же вещества так взаимодействуют друг с другом, что одни отдают электроны (окисляются), а другие их присоединяют (восстанавливаются). Например, растворение хлора в воде:
Cl20 + H2O = HCl+1O + HCl-1 или
(Cl0Cl0 + H2O = HCl+1O + HCl-1).
В обиход химиков, изучающих рассматриваемые процессы, наряду с химическими эквивалентами вошли окислительный и восстановительный эквиваленты. Это частное от деления молярной массы вещества на число приобретаемых (или теряемых) электронов. Так, в реакции
5H2S + 2KMnO4 + 3H3SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O
для KMnO4 окислительный эквивалент равен 158,15/5, а для сероводорода восстановительный эквивалент – половине его молярной массы.
Методика составления окислительно–восстановительных реакций на основе электронного баланса
С точки зрения электронной теории окислительно–восстановительными реакциями называются такие реакции, при протекании которых происходит переход электронов от одних атомов, молекул или ионов к другим. Поскольку электроны в окислительно–восстановительных реакциях переходят только от восстановителя к окислителю, а молекулы исходных веществ и продуктов реакции электронейтральны, то число электронов, отданных восстановителем всегда равно числу электронов, принятых окислителем. Это положение называется принципом электронного баланса и лежит в основе нахождения коэффициентов в уравнениях окислительно–восстановительных реакций.
Согласно этому принципу число молекул окислителя и число молекул восстановителя в уравнении окислительно-восстановительных реакций должны быть такими, чтобы количество принимаемых и отдаваемых электронов было одинаковым.
Рассмотрим применение принципа электронного баланса при нахождении коэффициентов в уравнениях окислительно–восстановительных реакций на конкретных примерах.
1. При каталитическом окислении аммиака NH3 кислородом О2 образуется оксид азота NO и вода Н2О. Запишем схему процесса с помощью формулы:
NH3 + O2 ® NO + H2O.
Над символами элементов, изменяющих в процессе реакции СО, подпишем их значения:
N-3H3 + O20 ® N+2O-2 + H2O-2.
Из изменения величины СО видно, что азот в молекуле аммиака окислился, а молекула кислорода – восстановилась, то есть аммиак является восстановителем, а кислород – окислителем. Из этой схемы также вытекает, что атом азота, изменяя СО от -3 до +2, отдает кислороду пять электронов. Поскольку водород СО не меняет, то молекула аммиака будет отдавать всего 5 электронов. Атом кислорода принимает 2 электрона (СО меняется от 0 до -2), следовательно, молекула кислорода будет принимать 4 электрона. Запишем указанные процессы в виде схемы:
| N-3 - 5ē ® N+2 5 O20 + 4ē ® 2O-2 4 | 4 окисление – восстановитель 5 восстановление - окислитель |
Согласно принципу электронного баланса количества молекул окислителя и восстановителя нужно взять такими, чтобы числа принимаемых и отдаваемых электронов были равными. Для этого находится общее кратное, а затем делится на число отдаваемых или приобретаемых электронов; полученные коэффициенты ставятся соответственно перед молекулой восстановителя и окислителя. Из этой схемы видно, что 4 молекулы NH3 отдают 20 электронов, которые принимаются 5 молекулами О2. Коэффициенты электронного баланса называются основными коэффициентами. Они никаким изменениям не подлежат:
4NH3 + 5O2 ® NO + H2O.
Все остальное уравнивается в соответствии с их величиной:
4NH3 + 5O2 ® 4NO + 6H2O.
2. При окислении сульфида мышьяка As2S3 азотной кислотой HNO3 образуются мышьяковистая кислота H3AsO4, серная H2SO4 и оксид азота NO.
Составим схему реакции, указывая СО над символами тех элементов, у которых в процессе реакции они изменяются:
As2+3S3-2 + HN+5O3 ® H3As+5O4 + H2S+6O4 + N+2O.
Подсчитаем количество электронов, отдаваемых молекулой восстановителя и принимаемых молекулой окислителя. Мышьяк изменяет СО от +3 до +5, отдавая 2 электрона. Два атома в молекуле мышьяка As2S3 отдадут 4 электрона. Сера меняет СО от -2 до +6, отдавая 8 электронов. Три атома серы этой молекулы отдают 24 электрона. Всего одна молекула As2S3 отдает 28 электронов. Принимает электроны азот в HNO3, изменяя СО от +5 до +2. Следовательно, каждая молекула HNO3 принимает 3 электрона. Запишем это в виде схемы:
| As2+3S3-2 - 28ē = 2As+5 + 3S+6 (окисление) N+5 + 3ē = N2+ (восстановление) |
Очевидно, что для соблюдения электронного баланса надо взять 3 молекулы As2S3 (3·28=84) и 28 молекул HNO3 (3·28=84), все остальные коэффициенты уравниваются в соответствии с этими основными коэффициентами:
3As2S3 + 28HNO3 => 6H3AsO4 + 9H2SO4 + 28NO.
Подсчет атомов водорода показывает, что в левой части их 28, а в правой – 36. Кислорода в правой части 84 атома, в правой – 88. Если водород или кислород не входят в уравнение реакции в виде простых веществ, то они уравниваются добавлением нужного количества молекул воды в ту часть уравнения, где их недостает. Поэтому подсчет атомов кислорода или водорода проводят в последнюю очередь, причем уравнивание водорода добавлением молекул воды приводит к автоматическому уравниванию кислорода и наоборот. Если водород или кислород входят в уравнение реакции в виде простых веществ, то их необходимо уравнивать независимо друг от друга.
Окончательно рассматриваемое уравнение реакции будет иметь вид:
3As2S3 + 28HNO3+ 4Н2О = 6H3AsO4+ 9H2SO4 + 28NO.
3. Если числа электронов, отдаваемых молекулой восстановителя и принимаемых молекулой окислителя, имеют общий делитель, то на него можно сократить основные коэффициенты, например:
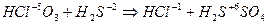
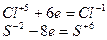
| (восстановление) (окисление) |
Наибольший общий делитель равен 2. Коэффициенты в уравнении будут
4HСlO3 + 3H2S = 4HCl + 3H2SO4.
Электронный баланс в данном случае 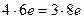 .
.
4. Если число участвующих в реакции атомов нечетное, а в результате ее должно получиться четное число атомов хотя бы одного из изменяющихся СО элементов, то основные коэффициенты удваиваются:
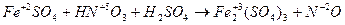
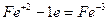
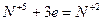
| (окисление) (восстановление) |
6FeSO4 + 2HNO3 + 3H2SO4 = 3Fe2(SO4)3 + 2NO + 4H2O.
В рассмотренном примере в протекании окислительно-восстановительной реакции принимает участие серная кислота. Она необходима для связывания образовавшегося трехвалентного железа. Нужное количество молекул H2SO4 определяется после расстановки коэффициентов перед продуктами реакции в соответствии с основными коэффициентами в левой части уравнения. Водород или кислород уравниваются в последнюю очередь добавлением молекул воды.
5. Окислитель или восстановитель, кроме основной окислительно-восстановительной реакции, расходуется также на связывание образующихся продуктов реакции. Например:
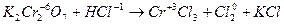
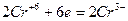
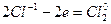
| 3 группы по два иона хлора, всего шесть ионов хлора | (восстановление) (окисление) |
 K2Cr2O7 + 6HCl 2CrCl3 + 3Cl2 + 2KCl.
K2Cr2O7 + 6HCl 2CrCl3 + 3Cl2 + 2KCl.
На связывание продуктов реакции в соответствии с основными коэффициентами необходимо 8 молекул HCl, которые не окисляются (на образование 2 молекул CrCl3 и 2 молекул KCl). Таким образом:
 K2Cr2O7 + 6HCl + 8HCl ® 2CrCl3 + 3Cl2 + 2KCl.
K2Cr2O7 + 6HCl + 8HCl ® 2CrCl3 + 3Cl2 + 2KCl.
на восстановление на связывание
Уравниваем водород или кислород, добавив в правую часть уравнения 7 молекул воды H2O, и получим окончательно:
K2Cr2O7 + 14HCl ® 2CrCl3 + 3Cl2 + 2KCl + 7H2O.
6. 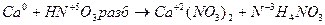
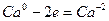
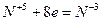
| (окисление) (восстановление) |
Основные коэффициенты 4 и 1:
 4Сa + HNO3 4Ca(NО3)2 + NH4NO3.
4Сa + HNO3 4Ca(NО3)2 + NH4NO3.
На связывание продуктов реакции требуется в соответствии с основными коэффициентами 9 молекул HNO3:
 4Сa + HNO3 + 9HNO3 4Ca(NО3)2 + NH4NO3 + 3H2O.
4Сa + HNO3 + 9HNO3 4Ca(NО3)2 + NH4NO3 + 3H2O.
на окисление на связывание
7. Оба элемента - и отдающий и принимающий электроны - находятся в одной молекуле. Для нахождения основных коэффициентов подобные процессы рассматривают как бы идущими справа налево:
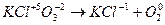
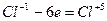 6 6
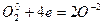 4 4
| (окисление) (восстановление) |
Основные коэффициенты 2 и 3 ставятся в правой части уравнения, левая часть уравнивается по правой части:
2KСlO3 = 2KCl + 3O2.
8. Один и тот же элемент окисляется и восстанавливается. Такие реакции называются реакциями диспропорционирования. В этом случае, так же как и в предыдущем, электронный баланс составляется справа налево:
4K2SO3+4 = 3K2SO4+6 + K2S-2
| S+6 + 2ē = S+4 S-2 - 6ē = S+4 | 3 (восстановление) 1 (окисление) |
Рассмотренный способ подбора коэффициентов в окислительно–восстановительных реакциях не является единственным. Существуют и другие способы. Однако во всех случаях главным остается нахождение основных коэффициентов электронного баланса.
Литература:
1. Глинка Н.Л. Общая химия. – М.: Химия, 1978. - С. 261-270.
2. Карапетьянц М.Х. Введение в теорию химических процессов. – М.: Высшая школа, 1981. - С. 90-106.
3. Шиманович И.В., Павлович М.Л., Тикавый П.Ф., Малашко П.М. Общая химия в формулах, определениях, схемах. – Мн.: Унiверсiтэцкае, 1996. - С. 14-32.
4. Кудрявцев А.А. Составление химических уравнений. – М.: Высшая школа, 1991. – 264 С.
5. Воробьев В.К., Елисеев С.Ю., Врублевский А.В. Практические и самостоятельные работы по химии. – Мн.: УП «Донарит», 2005. - С. 4-9, 65-75.
Тема 4. Энергетика химических процессов
Рассматриваемые вопросы:
1. Термохимические законы.
2. Энтальпии образования химических соединений.
3. Термохимические расчеты.
4. Энтропия.
5. Энергия Гиббса.
6. Направленность химических процессов. Оценка пожарной опасности веществ по энергии Гиббса.
Химическое превращение – это качественный скачок, при котором исчезают одни вещества и появляются другие. Происходящая при этом перестройка электронных структур атомов, ионов и молекул сопровождается выделением или поглощением тепла, света, электричества и т.д. – превращением химической энергии в другие виды энергии.
Энергетические эффекты химических реакций изучает термохимия. Данные об энергетических эффектах используются для выяснения направленности химических процессов, для расчета энергетических балансов технологических процессов и т.д. С их помощью можно рассчитать температуру горения различных веществ и материалов, температуру пожаров и т.п.
Состояние системы (вещества или совокупности рассматриваемых веществ) описывают с помощью ряда параметров состояния – t, p, m. Для характеристики состояния системы и происходящих в ней изменений важно знать также изменение таких свойств системы, как ее внутренняя энергия U, энтальпия Н, энтропия S, энергия Гиббса (изобарно-изотермический потенциал) G. По изменению этих свойств системы можно судить, в частности, об энергетике процессов.
Химические реакции обычно протекают при постоянном объеме V = const, DV = 0 (например, в автоклаве) или при постоянном давлении p = const (например, в открытой колбе), т.е. является соответственно изохорными или изобарными процессами.
Энергетический эффект химического процесса возникает за счет изменения в системе внутренней энергии U или энтальпии H. Внутренней энергией системы называют энергию всех видов движения и взаимодействия тел или частиц, составляющих систему (кинетическая энергия межмолекулярного взаимодействия, вращательная энергия, колебательное движение атомов и групп в молекуле, энергия взаимодействия электронов между собой и с ядрами).
Предположим, что некоторая система за счет поглощения теплоты q переходит из состояния 1 в состояние 2. В общем случае эта теплота расходуется на изменение внутренней энергии системы DU и на совершение работы против внешних сил А: 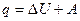 или
или 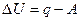 .
.
Приведенное уравнение выражает закон сохранения энергии (который называется также первым законом термодинамики), т.е. означает что сумма изменения внутренней энергии и совершенной системой (или над нею) работы равна сообщенной (или выделенной ею) теплоте. Так, если теплота сообщается газу в цилиндре, закрытом поршнем, то газ, во-первых, нагревается, т.е. его внутренняя энергия возрастает, а во-вторых, расширяется, т.е. производит работу подъема поршня А.
Вообще, следует отметить, что ни запасом теплоты, ни запасом работы система не обладает. Система обладает лишь запасом внутренней энергии, а теплота и работа показывают, каким способом изменяется внутренняя энергия системы.
Для химических реакций под работой против внешних сил в основном подразумевается работа против внешнего давления. В первом приближении (при p = const) она равна произведению давления р на изменение объема системы DV при переходе ее из состояния 1 в состояние 2:
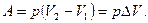
При изохорном процессе (V = const), поскольку изменения объема системы не происходит, А = 0. Тогда переходу системы из состояния 1 в состояние 2 отвечает равенство: 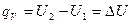 . Таким образом, если химическая реакция протекает при постоянном объеме, то выделение или поглощение теплоты qv связано с изменением внутренней энергии системы.
. Таким образом, если химическая реакция протекает при постоянном объеме, то выделение или поглощение теплоты qv связано с изменением внутренней энергии системы.
При изобарном процессе (p = const) тепловой эффект qр равен:
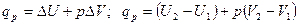 или
или
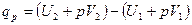 .
.
Введем обозначение 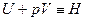 .
.
Тогда qp = H2 – H1 = DH.
Величину Н называют энтальпией. Энтальпию можно рассматривать как энергию расширенной системы. Таким образом, если при изохорном процессе энергетический эффект реакции равен изменению внутренней энергии системы 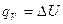 , то в случае изобарного процесса он равен изменению энтальпии системы
, то в случае изобарного процесса он равен изменению энтальпии системы 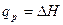 .
.
Химические и физические изменения в системе, как правило, сопровождаются выделением и поглощением теплоты. Наибольшую теплоту, которую можно получить при химическом процессе при данной температуре, называют тепловым эффектом процесса. Процессы в химии, при которых теплота выделяется, называются экзотермическими, а процессы, при которых теплота поглощается, - эндотермическими. Тепловые эффекты экзотермических реакций в термохимии принято считать положительными, а эндотермических функций – отрицательными. В отличие от термохимии в химической термодинамике, наоборот, положительные значения принимаются для тепла (Q), поглощенного системой. С целью согласовать систему знаков, будем тепловой эффект процесса обозначать через Q и считать, что
Q = -q, т.е. QV = -DU; QP = -DH.
(В химической термодинамике: q – поглощаемая энергия - положительна; q - отдаваемая (излучаемая) энергия – отрицательна.)
Энергетический эффект реакции, протекающей при постоянном давлении, отличается от энергетического эффекта реакции, протекающей при постоянном объеме, на величину pDV. Для химического процесса, протекающего изобарически, DV представляет собой разность между суммой объемов исходных веществ и продуктов реакции. Так, для реакции, записанной в общем виде:
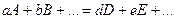 ,
,
изменение объема определяется равенством
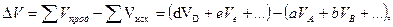
где VA, VB, …, VD, VE… - молярные объемы веществ A, B, …, D, E…; åVпрод – сумма молярных объемов продуктов реакции; åVисх – сумма молярных объемов исходных веществ.
Следует отметить, что подавляющее большинство химических реакций происходит при постоянном давлении. Поэтому таким реакциям в дальнейшем будет уделено наибольшее внимание.
Тепловые эффекты реакций определяют как экспериментально, так и с помощью термохимических расчетов. Абсолютные значения внутренней энергии и энтальпии определить невозможно. Однако для термохимических расчетов это несущественно, т.к. здесь представляет интерес энергетический эффект процесса, т.е. изменение состояния системы – изменение значений U и H (DU и DН).
При экзотермических реакциях теплота выделяется, т.е. уменьшается энтальпия, или внутренняя энергия системы, и значения DН и DU для них отрицательны.
При эндотермических реакциях теплота поглощается, т.е. Н и U системы возрастают, а DН и DU имеют положительные значения (это значит, что продукт реакции менее устойчив, чем исходное вещество).
Для того, чтобы можно было сравнивать энергетические эффекты различных процессов, термохимические расчеты обычно относят к 1 моль вещества и условиям, принятым за стандартные. За стандартные принимают давление 101325 Па и температуру 25 оС (298,15 К). Стандартные тепловые эффекты принято обозначать 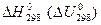 .
.
Уравнения химических реакций с указанием тепловых эффектов называют термохимическими уравнениями.
Термохимическое уравнение реакции синтеза 1 моля воды имеет вид:
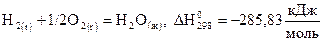 .
.
В термохимических уравнениях указывается также агрегатное состояние и полиморфная модификация реагирующих и образующихся веществ: г – газовое, ж – жидкое, к – кристаллическое и т.д.
В основе термохимических расчетов лежит закон, сформулированный Гессом Г.И. (1841):
Тепловой эффект зависит только от вида (природы) и состояния исходных веществ и конечных продуктов, но не зависит от пути процесса, т.е. от числа и характера промежуточных стадий.
Так, образование оксида углерода (IV) из графита и кислорода можно рассматривать или как непосредственный результат взаимодействия простых веществ:
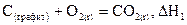 ,
,
или как результат процесса, протекающего через промежуточную стадию образования и сгорания оксида углерода (II):

или суммарно
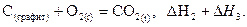
Согласно закону Гесса, тепловые эффекты образования СО2 как непосредственно из простых веществ, так и через промежуточную стадию образования и сгорания СО равны
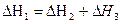 .
.
По приведенному равенству нетрудно вычислить одну из величин DН, зная две другие. Как известно, тепловые эффекты образования СО2 (DН1) и горения СО (DН3) определяются экспериментально. Тепловой же эффект образования СО (DН2) измерить невозможно, т.к. при горении углерода в условиях недостатка кислорода образуется смесь СО и СО2. Но теплоту образования СО можно рассчитать по известным значениям 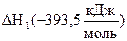 и
и 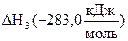 :
: 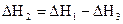 ;
;  .
.
Следствия из закона Гесса:
1. Тепловой эффект обратной реакции равен тепловому эффекту прямой реакции с обратным знаком, т.е. для реакций
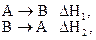
отвечающие им тепловые эффекты 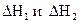 связаны равенством
связаны равенством
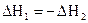 .
.
2. Если в результате ряда последовательных химических реакций система приходит в состояние, полностью совпадающее с исходным (круговой процесс), то сумма тепловых эффектов этих реакций равна нулю, т.е. для ряда реакций
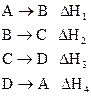
сумма их тепловых эффектов
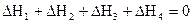 .
.
В термохимических расчетах широко используют энтальпии (теплоты) образования веществ.
Под энтальпией образования понимают тепловой эффект реакции образования 1 моля вещества из простых веществ. Обычно используют стандартные энтальпии образования. Их обозначают 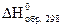 или
или 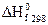 (часто один из индексов опускают; f – от англ. formation).
(часто один из индексов опускают; f – от англ. formation).
Стандартные энтальпии образования простых веществ, устойчивых в стандартных условиях (газообразный кислород, жидкий бром, кристалллический иод, ромбическая сера, графит и т.д.), принимают равными нулю.
Согласно закону Гесса тепловой эффект реакции равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ. Для реакций вида
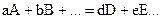
тепловой эффект DНх.р. определяется равенством

или
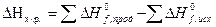 .
.
Примеры.
1. Для реакции взаимодействия кристаллического оксида алюминия и газообразного оксида серы (VI)
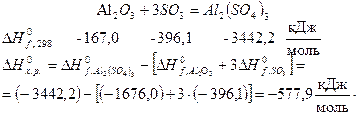
2. Реакция термического разложения СаСО3:
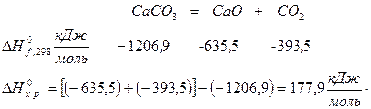
3. Реакция разложения бертолетовой соли
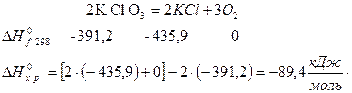
Энтальпии образования известны примерно для 4000 веществ в различных агрегатных состояниях. Это позволяет чисто расчетным путем установить энергетические эффекты самых разнообразных процессов.
Большинство процессов представляет собой два одновременно происходящих явления: передачу энергии и изменение в упорядоченности расположения частиц относительно друг друга.
Частицам (атомам, ионам) присуще стремление к беспорядочному движению, поэтому система стремится перейти из более упорядоченного состояния в менее упорядоченное.
Так, если, например, баллон с газом соединить с сосудом, то газ из баллона будет распределяться по всему объему сосуда. При этом система из более упорядоченного состояния (с меньшим беспорядком) переходит в состояние менее упорядоченное (с большим беспорядком).
Количественной мерой беспорядка является энтропия S.
Или другими словами: энтропия – мера неупорядоченности системы. Ее представляют как логарифмическое выражение вероятности существования вещества или различных его форм:
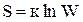 ,
,
где S – энтропия, 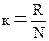 - коэффициент пропорциональности (к – постоянная Больцмана), W – термодинамическая вероятность существования вещества или какой-либо его формы, т.е. число возможных микросостояний, соответствующих данному макросостоянию вещества.
- коэффициент пропорциональности (к – постоянная Больцмана), W – термодинамическая вероятность существования вещества или какой-либо его формы, т.е. число возможных микросостояний, соответствующих данному макросостоянию вещества.
При переходе системы из более упорядоченного состояния в менее упорядоченное энтропия возрастает (DS > 0). Чтобы оценить изменение энтропии при переходе из состояния 1 в состояние 2 необходимо, как обычно, из величины какого-либо свойства, характеризующего конечное состояние, вычесть величину того же свойства, характеризующего начальное состояние:
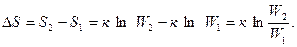
II закон термодинамики: в изолированных системах энтропия самопроизвольно протекающего процесса возрастает, т.е. DS > 0.
Переход же системы из менее упорядоченного состояния в более упорядоченное связан с уменьшением энтропии, и самопроизвольное протекание подобного процесса менее вероятно. Так, ясно, что в рассматриваемом примере невероятно, чтобы газ самостоятельно собрался в баллоне.
В случае перехода системы из менее упорядоченного состояния в более упорядоченное энтропия системы уменьшается (DS < 0).
Нетрудно понять, что энтропия возрастает при переходе жидкости в пар, при растворении кристаллического вещества, при расширении газов и т.д. Во всех этих случаях наблюдается уменьшение порядка в относительном расположении частиц. Наоборот, в процессах конденсации, кристаллизации веществ энтропия уменьшается.
Вероятность существования различных соединений вещества (газ, кристаллическое, жидкое) можно описать как некоторое свойство и количественно выразить значением энтропии S. [Энтропия может измеряться в энтропийных единицах 1 э.е. = 1 кал/(моль×град.) = 4,1868 Дж/моль×град.] Энтропии веществ, как и энтальпии их образования, принято относить к определенным условиям. Обычно это стандартные условия. Энтропию в этом случае обозначают 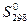 и называют стандартной.
и называют стандартной.
В соответствии со степенью беспорядка энтропия вещества в газовом состоянии значительно выше, чем в жидком, а тем более – в кристаллическом. Например, 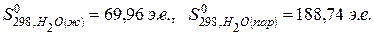
При данном агрегатном состоянии энтропия тем значительнее, чем больше атомов в молекуле. Например,
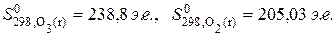 ;
;
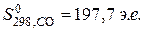
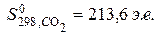
Чем больше твердость вещества, тем меньше его энтропия. Энтропия возрастает с увеличением степени дисперсности частиц вещества.
Для химических реакций в целом
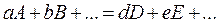
изменение энтропии будет
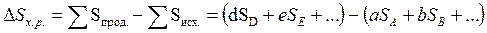 .
.
Об изменении энтропии в химической реакции можно судить по изменению объема в ходе реакции:
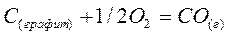 ,
, 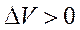 и
и 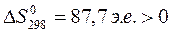 ;
;
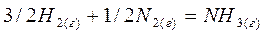
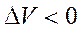 и
и 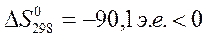 .
.
Если в реакции участвуют только твердые и образуются только твердые вещества или число молей газообразного вещества не изменяется, то изменение энтропии в ходе ее очень незначительно.
В стандартных условиях энтропия простого вещества не равна нулю.
III закон термодинамики: энтропия чистых веществ, существующих в виде идеальных кристаллов при температуре 0 К, равна нулю.
Стремление системы к возрастанию энтропии называют энтропийным фактором. Этот фактор тем больше, чем выше температура. Количественно энтропийный фактор оценивается произведением Т·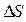 .
.
Стремление системы к понижению потенциальной энергии называют энтальпийным фактором. Количественно эта тенденция системы выражается через тепловой эффект процесса, то есть значением 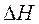 .
.
Самопроизвольно, то есть без затраты работы извне, система может переходить из менее устойчивого состояния в более устойчивое.
В химических процессах одновременно действуют две тенденции: стремление частиц объединиться за счет прочных связей в более сложные, что уменьшает энтальпию системы, и стремление частиц разъединяться, что увеличивает энтропию. Иными словами, проявляется действие двух прямо противоположных факторов – энтальпийного (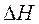 ) и энтропийного (Т·
) и энтропийного (Т·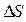 ). Суммарный эффект этих двух противоположных тенденций в процессах, протекающих при постоянных Т и р, отражает изменение энергии Гиббса DG (или изобарно–изотермического потенциала):
). Суммарный эффект этих двух противоположных тенденций в процессах, протекающих при постоянных Т и р, отражает изменение энергии Гиббса DG (или изобарно–изотермического потенциала):
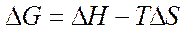 .
.
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности или невозможности осуществления процесса. Условием принципиальной возможности являются неравенство:
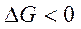 (условие самопроизвольности).
(условие самопроизвольности).
Иными словами, самопроизвольно протекают реакции, если энергия Гиббса в исходном состоянии системы больше, чем в конечном.
Увеличение энергии Гиббса (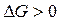 ) свидетельствует о невозможности самопроизвольного осуществления процесса в данных условиях.
) свидетельствует о невозможности самопроизвольного осуществления процесса в данных условиях.
Если же 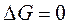 , то система находится в состоянии химического равновесия.
, то система находится в состоянии химического равновесия.
В соответствии с уравнением  самопроизвольному протеканию процесса способствует уменьшение энтальпии и увеличение энтропии системы, то есть когда
самопроизвольному протеканию процесса способствует уменьшение энтальпии и увеличение энтропии системы, то есть когда 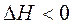 и
и 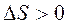 .
.
При других сочетаниях 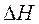 и
и  возможность процесса определяют либо энтальпийный, либо энтропийный фактор.
возможность процесса определяют либо энтальпийный, либо энтропийный фактор.
Рассмотрим две следующие реакции:
1) 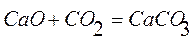
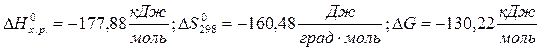 ;
;
2) 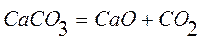
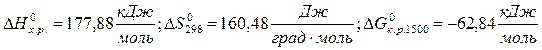 .
.
Первая реакция экзотермическая, протекает с уменьшением объема. Возможность этой реакции (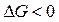 ) определяется действием энтальпийного фактора, которое перекрывает противодействие энтропийного фактора:
) определяется действием энтальпийного фактора, которое перекрывает противодействие энтропийного фактора: 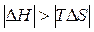 .
.
Вторая реакция эндотермическая. Протекает с увеличением объема. Возможность этой реакции (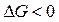 ), наоборот, определяется энтропийным фактором. При высокой температуре энтропийный фактор перекрывает энтальпийный фактор:
), наоборот, определяется энтропийным фактором. При высокой температуре энтропийный фактор перекрывает энтальпийный фактор: 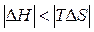 . Реакция протекает самопроизвольно.
. Реакция протекает самопроизвольно.
Согласно уравнению 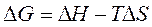 влияние температуры на
влияние температуры на 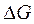 определяется знаком и величиной
определяется знаком и величиной 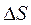 .
.
Для реакции с 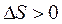 (2C + O2 Þ 2CO) повышение температуры приводит к увеличению отрицательного значения
(2C + O2 Þ 2CO) повышение температуры приводит к увеличению отрицательного значения 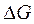 . Для реакции с
. Для реакции с 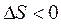 (2Hg + O2 Þ 2HgO) с повышением температуры отрицательное значение
(2Hg + O2 Þ 2HgO) с повышением температуры отрицательное значение 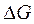 уменьшается; в этом случае высокотемпературный режим препятствует протеканию процесса. При соответствующей температуре
уменьшается; в этом случае высокотемпературный режим препятствует протеканию процесса. При соответствующей температуре 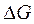 приобретает положительное значение, и реакция должна протекать в обратном направлении. Если же при протекании процесса энтропия системы не изменяется
приобретает положительное значение, и реакция должна протекать в обратном направлении. Если же при протекании процесса энтропия системы не изменяется 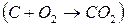 , то значение
, то значение 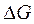 реакции от температуры практически не зависит.
реакции от температуры практически не зависит.
При высоких температурах самопроизвольно можут протекать реакции, сопровождающиеся увеличением энтропии, при низких температурах – только экзотермические реакции.
Процессы, протекающие с уменьшением энтальпии (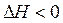 ) и увеличением энтропии (
) и увеличением энтропии (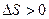 ), практически необратимы. В этом случае
), практически необратимы. В этом случае 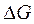 всегда будет иметь отрицательное значение, какую бы температуру не применяли. Так, для реакции
всегда будет иметь отрицательное значение, какую бы температуру не применяли. Так, для реакции
2КClO3 = 2KCl+3O2
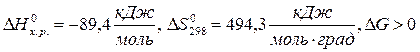 при любой температуре.
при любой температуре.
Под стандартной энергией Гиббса образования 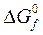 понимают изменение энергии Гиббса при реакции образования 1 моля вещества в стандартных условиях из простых веществ, находящихся в стандартном состоянии.
понимают изменение энергии Гиббса при реакции образования 1 моля вещества в стандартных условиях из простых веществ, находящихся в стандартном состоянии.
Стандартная энергия Гиббса образования простого вещества, устойчивого в стандартных условиях, равна нулю.
Изменение энергии Гиббса, как и изменение энтальпии системы, не зависит от пути процесса. Поэтому для реакции вида
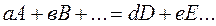
изменение стандартной энергии Гиббса 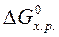 равно разности между суммой стандартных энергий Гиббса образования продуктов реакции и суммой стандартных энергий Гиббса образования исходных веществ:
равно разности между суммой стандартных энергий Гиббса образования продуктов реакции и суммой стандартных энергий Гиббса образования исходных веществ:
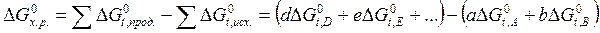 .
.
Для реакции NO + 1/2О2 = NO2
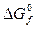 86,58 0 51,5
86,58 0 51,5 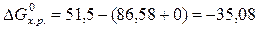 кДж/моль.
кДж/моль.
При пользовании значениями 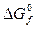 критерием принципиальной возможности процесса в нестандартных условиях следует принять условие
критерием принципиальной возможности процесса в нестандартных условиях следует принять условие 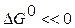 , а критерием принципиальной невозможности осуществления процесса - неравенство
, а критерием принципиальной невозможности осуществления процесса - неравенство 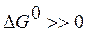 . Равенство
. Равенство 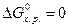 означает, что система находится в равновесии.
означает, что система находится в равновесии.
Во многих случаях значениями 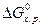 можно пользоваться лишь для приближенной оценки направления протекания реакций.
можно пользоваться лишь для приближенной оценки направления протекания реакций.
| Состояние | 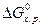 , ккал/моль , ккал/моль
| |
| CF4 | -375,8 (вещество инертное, стабильное) | |
| NCl3(ж) | 70 (вещество взрывоопасное) | |
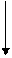 C3H8 C3H8
| -5,61 | Реакционная способность возрастает |
| C3H6 | 14,99 | |
| C3H4 | 46,47 |
Чем отрицательнее значение 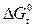 вещества, тем данное химическое соединение устойчивее. И наоборот, чем положительней
вещества, тем данное химическое соединение устойчивее. И наоборот, чем положительней 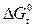 , тем менее устойчиво данное вещество.
, тем менее устойчиво данное вещество.
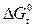 известны для немногих соединений, но вместе с тем с помощью
известны для немногих соединений, но вместе с тем с помощью 
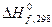 и
и 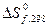 можно вычислить
можно вычислить 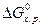 для десятков тысяч реакций, в том числе предполагаемых и не изученных экспериментально.
для десятков тысяч реакций, в том числе предполагаемых и не изученных экспериментально.
В складских помещениях сосредоточены большие количества разнообразных по ассортименту и физико–химическим (в том числе и пожароопасным) свойствам веществ. При нарушении правил хранения возможно образование смесей, способных к экзотермическим реакциям. Такие смеси представляют значительную пожарную опасность. Одни смеси, образованные при контакте негорючего окислителя с горючим, самовозгораются (KMnO4+глицерин; CrO3+ацетон). Другие смеси воспламеняются или взрываются от удара, трения или нагревания (KClO3+сера). Третьи смеси, образованные из негорючих компонентов, при взаимодействии нагревается от теплоты реакции (CaO+вода) или взрываются (KClO3+H2SO4).
Пожарную опасность веществ и их смесей можно определить по энергии Гиббса 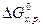 , которая является мерой реакционной способности веществ. Как было показано ранее, реакции между веществами, сопровождающиеся большой потерей энергии Гиббса, протекают самопроизвольно и до конца, иногда приобретают взрывной характер. В этих реакциях энергия Гиббса отрицательна, то есть в исходном состоянии системы (реагирующих веществ) она больше, чем в конечном (продуктов реакции).
, которая является мерой реакционной способности веществ. Как было показано ранее, реакции между веществами, сопровождающиеся большой потерей энергии Гиббса, протекают самопроизвольно и до конца, иногда приобретают взрывной характер. В этих реакциях энергия Гиббса отрицательна, то есть в исходном состоянии системы (реагирующих веществ) она больше, чем в конечном (продуктов реакции).
Ориентировочно за величину, определяющую направленность процесса, принимают значение 41,8 кДж/моль. Если для реакции расчетом получено 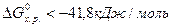 , то реакция возможна не только в стандартных, но и в нестандартных условиях.
, то реакция возможна не только в стандартных, но и в нестандартных условиях.
Если 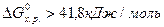 , то процесс невозможен как в стандартных, так и в иных условиях. По изменению энергии Гиббса от -41,8 до 41,8 кДж/моль нельзя сделать заключения о возможности протекания процесса в стандартных условиях, но вещества относятся к пожароопасным, хотя эти свойства у них появляются в условиях, отличных от стандартных (например, во время пожара).
, то процесс невозможен как в стандартных, так и в иных условиях. По изменению энергии Гиббса от -41,8 до 41,8 кДж/моль нельзя сделать заключения о возможности протекания процесса в стандартных условиях, но вещества относятся к пожароопасным, хотя эти свойства у них появляются в условиях, отличных от стандартных (например, во время пожара).
Если для веществ по расчету получено 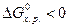 , то вещества, участвующие в реакции, пожароопасны и несовместимы. К совместному хранению такие вещества не допускаются. При
, то вещества, участвующие в реакции, пожароопасны и несовместимы. К совместному хранению такие вещества не допускаются. При 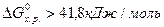 вещества совместимые и допускаются к совместному хранению.
вещества совместимые и допускаются к совместному хранению.
Возможность использования энергии Гиббса для оценки пожарной опасности вещества подтверждается следующими примерами.
Пример 1. Определить пожарную опасность разложения твердого окислителя KMnO4 при нагревании. Разложение вещества идет по схеме:
2KMnO4 Þ K2MnO4 + MnO2 + O2.
Решение. Из справочника термодинамических величин находим 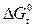 веществ, кДж/моль:
веществ, кДж/моль:
 KMnO4 – 729,6
KMnO4 – 729,6
K2MnO4 – 1169,2
MnO2 – 467
Находим 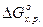 :
:
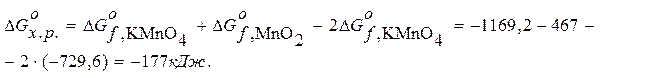 -88,5 кДж/моль < - 41,8 кДж/моль – процесс разложения KMnO4 идет самопроизвольно.
-88,5 кДж/моль < - 41,8 кДж/моль – процесс разложения KMnO4 идет самопроизвольно.
Практически разложение марганцовки при стандартных условиях не происходит. Несмотря на это, KMnO4 следует считать пожароопасным веществом, так как при 240 °С процесс становится самопроизвольным и активным, с выделением О2, что представляет пожарную опасность.
Пример 2. Установить пожарную опасность контакта негорючего CrO3 с горючей жидкостью ацетоном.
3C3H6O + 16CrO3 Þ 8Cr2O3 + 9CO2 + 9H2O
Решение: Находим из справочника 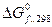 , кДж/моль:
, кДж/моль:
CrO3 ï – 513,8 кДж/моль
Cr2O3 ï – 1059,7 кДж/моль
Ацетон ï – 155,5 кДж/моль
CO2 ï – 394,6 кДж/моль
H2O(г) ï – 237,4 кДж/моль
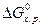 = 8(-1059,7) + 9(-237,4) + 9 (-394,6) - 3(-155,5) - 16(-513,8) = -5478,3 кДж.
= 8(-1059,7) + 9(-237,4) + 9 (-394,6) - 3(-155,5) - 16(-513,8) = -5478,3 кДж.
Из расчета на один моль ацетона: -1826,1 кДж/моль < - 41,8 кДж/моль – возможен самопроизвольный процесс в стандартных условиях.
Эксперимент показывает, что контакт этих веществ приводит к самовозгоранию и взрыву. Следовательно, совместное хранение этих веществ с точки зрения пожарной безопасности недопустимо.
Литература:
1. Глинка Н.Л. Общая химия. – М.: Химия, 1978. – С. 183-201.
2. Карапетьянц М.Х. Введение в теорию химических процессов. – М.:
Высшая школа, 1981. – С. 7-75
3. Шиманович И.В., Павлович М.Л., Тикавый П.Ф., Малашко П.М. Общая
химия в формулах, определениях, схемах. – Мн.: Унiверсiтэцкае, 1996.
– С. 89-102.
4. Кудрявцев А.А. Составление химических уравнений. – М.: Высшая школа, 1991. – 264 С.
5. Воробьев В.К., Елисеев С.Ю., Врублевский А.В. Практические и самосто-
ятельные работы по химии. – Мн.: УП «Донарит», 2005. – С. 30-39.
Тема 5. Химическая кинетика и равновесие в гомогенных системах
Рассматриваемые вопросы:
1. Факторы, влияющие на скорость химической реакции.
2. Энергия активации химических реакций.
3. Цепные реакции.
4. Обратимые химические реакции. Химическое равновесие.
5. Факторы, влияющие на химическое равновесие.
6. Управление химическими процессами как фактор, обеспечивающий пожаровзрывобезопасность химических производств.
Химической кинетикой называется учение о скорости химических реакций и ее зависимости от различных факторов (концентрации реагентов, t, Р, катализатора и т.д.).
Химические реакции протекают с различной скоростью. Одни реакции заканчиваются в течение долей секунды (разложение взрывчатых веществ), другие – продолжаются минутами, часами, сутками, третьи – длятся десятки, сотни, тысячи лет (процессы, протекающие в земной коре).
Скорость конкретной реакции тоже может изменяться в широких пределах в зависимости от условий ее протекания (смесь водорода и кислорода при обычной температуре может сохраняться без изменений неограниченное время; при введении в нее соответствующего катализатора она реагирует весьма бурно; при 630 °С она реагирует и без катализатора).
Фазой называется часть системы, отличающаяся по своим физическим и химическим свойствам от других частей системы и отделенная от них поверхностью раздела, при переходе через которую свойства системы резко меняются.
Системы, состоящие из одной фазы, называются гомогенными, из нескольких фаз – гетерогенными. Соответственно реакции, в которых взаимодействующие вещества находятся в одной фазе, называются гомогенными, а реакции, в которых вещества соединяются в различных фазах – гетерогенными.
Скорость гомогенной химической реакции принято выражать изменением концентрации реагирующих веществ или образовывающихся продуктов реакции в единицу времени. Концентрации исходных веществ в ходе реакции уменьшаются, а концентрации продуктов реакции возрастают во времени. Скорость гомогенной химической реакции по мере израсходования исходных веществ уменьшается.
Средняя скорость реакции vср в интервале времени от t1 до t2 определяется соотношением:
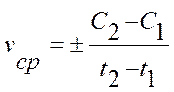 ;
; 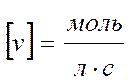 .
.
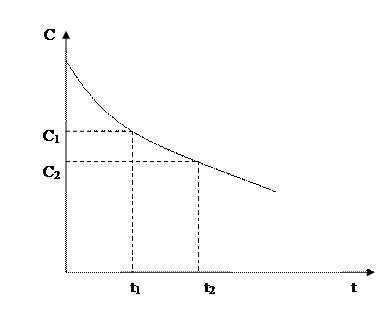
Рис. 5.1. Изменение концентрации исходных веществ во времени.
Мгновенная скорость – это скорость реакции в данный момент времени t. Она определяется производной от концентрации по времени:
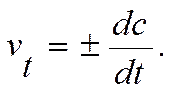
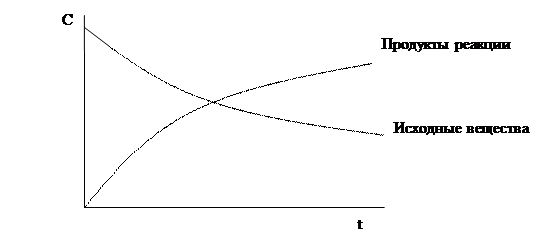
Рис. 5.2. Изменение концентрации реагирующих веществ во времени.
Скорость реакции всегда считается положительной. Если при расчетах берем изменение концентрации исходных веществ, то в указанном выражении ставится знак «-»; если это касается продуктов реакции, то следует принимать знак «+».
Факторы, влияющие на скорость химической реакции:
1. природа реагирующих веществ;
2. концентрация реагентов;
3. температура;
4. катализаторы;
5. дисперсность (для твердых веществ);
6. кислотность среды (для реакции в растворах);
7. форма реактора (для цепных реакций);
8. интенсивность освещения видимыми или УФ-лучами (для фотохимических реакций);
9. интенсивность облучения 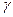 -лучами (для радиационно – химических реакций) и т.д.
-лучами (для радиационно – химических реакций) и т.д.
Природа реагирующих веществ
2NO + O2 = 2NO2 – идет при стандартных условиях.
2CO + O2 = 2CO2 – не реагирует при стандартных условиях, хотя чисто внешне уравнения данных реакций похожи, но природа веществ различна.
Концентрация реагентов
Необходимой предпосылкой взаимодействия веществ является столкновение молекул. Число столкновений, а значит и скорость химической реакции, зависит от концентрации реагирующих веществ: чем больше молекул, тем больше и столкновений.
| <== предыдущая страница | | | следующая страница ==> |
| Атомы неметаллов (за исключением фтора) в зависимости от | | | Закон действующих масс |
Дата добавления: 2014-04-24; просмотров: 1133; Нарушение авторских прав

Мы поможем в написании ваших работ!