
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Химические свойства. Реакции спиртов определяются присутствием группы ОН и протекают по следующим основным направлениям
Реакции спиртов определяются присутствием группы ОН и протекают по следующим основным направлениям.
1) Замещение водорода ОН группы под действием оснований (кислотные свойства).
2) Взаимодействие с электрофильными реагентами по атому кислорода с неподеленной парой электронов (основные и нуклеофильные свойства).
3) Взаимодействие с нуклеофильными реагентами по a-углеродному атому, несущему частичный положительный заряд (реакции нуклеофильного замещения ОН группы).
4) Дегидратация (участвуют связь С-Н в b-положении и связь С-О).
5) Окисление (участвуют связь С-Н в a-положении и связь О-Н).
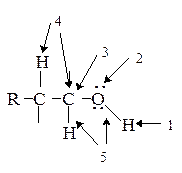
Кислотные свойства.Спирты взаимодействуют с активными металлами (Na, K, Mg, Al и др.) с образованием алкоголятов.
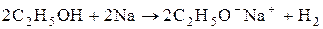

этилат натрия
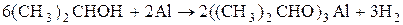
изопропилат алюминия
Алкоголяты образуются также при действии на спирты сильных оснований.
| + | 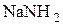
| D | 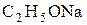
| + | 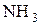
|
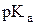 =15,9 =15,9
| 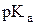 =33 =33
|
При взаимодействии спиртов со щелочами равновесие сдвинуто в сторону гидролиза алкоголятов, так как спирты являются более слабыми кислотами, чем вода:
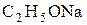
| + | 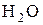
| D | 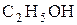
| + | NaOH |
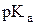 =15,7 =15,7
| 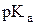 =15,9 =15,9
|
Кислотность спиртов в водных растворах уменьшается в ряду с увеличением длины и разветвленности радикала:
| CH3OH | первичный | вторичный | третичный | |
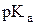
| 15,2 | ~16 | ~16,5 | ~17 |
Нуклеофильные свойства.Нуклеофильные свойства спиртов проявляются в их реакциях с карбоновыми и неорганическими кислотами и их производными, которые приводят к образованию сложных эфиров.

Для увеличения нуклеофильности спирты превращают в алкоголяты, которые способны взаимодействовать с галогенпроизводными с образованием простых эфиров:
R-Hal + R/ONa ® R-OR/ + NaHal
Однако алкоголят-ионы не только сильные нуклеофилы, но и сильные основания. Поэтому их взаимодействие с алкилгалогенидами может привести как к замещению, так и к элиминированию в зависимости от температуры и структуры алкилгалогенида и алкоголята. Например, для получения метилизопропилового эфира необходимо использовать метилиодид и изопропилат-анион, а не изопропилиодид и метилат-анион, так как в последнем случае будет доминировать реакция отщепления:
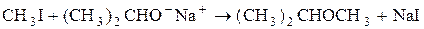 (
(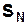 )
)
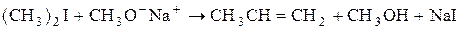 (E)
(E)
Основные свойства и реакции нуклеофильного замещения.Протекание реакции по схеме: R-OH + Y ® R-Y + OH-
невозможно, поскольку гидроксид-анион – это сильное основание и плохая уходящая группа. Для проведения  -реакций необходимо предварительно модифицировать ОН группу, превратив ее в хорошую уходящую группу. Для этого спирты переводят в оксониевые соединения или эфиры неорганических кислот:
-реакций необходимо предварительно модифицировать ОН группу, превратив ее в хорошую уходящую группу. Для этого спирты переводят в оксониевые соединения или эфиры неорганических кислот:
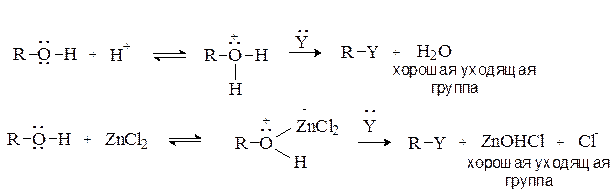
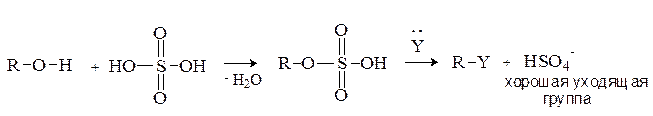
В биохимических процессах замещение ОН группы протекает через стадию превращения спиртов в эфиры фосфорной, дифосфорной и трифосфорной кислот, анионы которых являются легко уходящими группами:
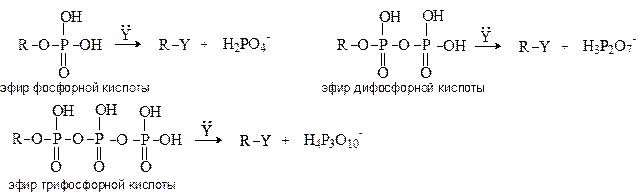
Замещение ОН группы на галоген.Спирты взаимодействуют с галогеноводородами и галогенидами фосфора и серы с образованием галогенпроизводных.
1) Действие галогеноводородов
R-OH + HHal ® R-Hal + 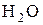
Реакция протекает через стадию протонирования ОН-группы с последующим нуклеофильным замещением по механизму 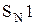 или
или 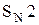 .
.
R-OH + HHal D 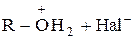 ® R-Hal +
® R-Hal + 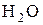
Первичные спирты реагируют по механизму 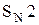 . Реакция идет медленно, так как в протонных растворителях (вода, спирты) галогенид-ионы – слабые нуклеофилы. Вторичные и третичные спирты реагируют по механизму
. Реакция идет медленно, так как в протонных растворителях (вода, спирты) галогенид-ионы – слабые нуклеофилы. Вторичные и третичные спирты реагируют по механизму 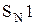 . Таким образом, реакционная способность спиртов возрастает в ряду:
. Таким образом, реакционная способность спиртов возрастает в ряду:
первичный < вторичный < третичный
Реакционная способность галогеноводородов увеличивается в ряду:
HCl < HBr < HI
параллельно с возрастанием силы кислот и нуклеофильности галогенид-анионов. Однако HI не может быть использована, так как легко восстанавливает спирты до углеводородов. HBr реагирует с первичными, вторичными и третичными спиртами. HCl при обычных условиях действует только на третичные спирты.
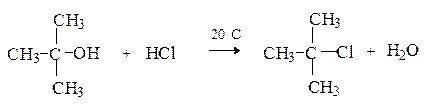
Для вторичных и первичных спиртов требуется присутствие катализатора – кислоты Льюиса.
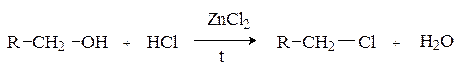
2) Действие галогенидов фосфора и серы
Замещение ОН группы действием 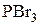 ,
, 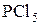 ,
, 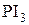 ,
, 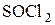 основано на предварительном превращении спирта в эфиры кислот фосфора и серы, которые затем атакуются галогенид-анионом.
основано на предварительном превращении спирта в эфиры кислот фосфора и серы, которые затем атакуются галогенид-анионом.
ROH + 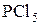 ® RCl +
® RCl + 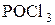 + HCl
+ HCl
ROH + 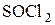 ® RCl +
® RCl + 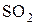 + HCl
+ HCl
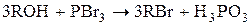
Образование простых эфиров.При нагревании спиртов в присутствии серной кислоты происходит замещение ОН группы на группу OR и образуются простые эфиры.
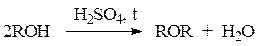
Реакция протекает через стадию протонирования спирта с последующим нуклеофильным замещением, в котором одна молекула спирта (протонированная) выполняет роль субстрата, а вторая – нуклеофила.
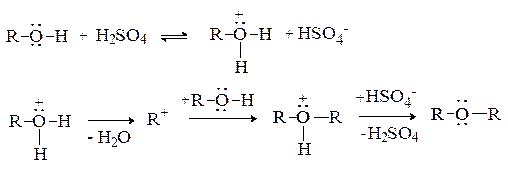
Дегидратация спиртов.При нагревании в присутствии кислотных катализаторов спирты отщепляют воду с образованием алкенов.
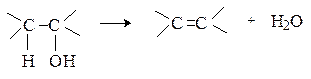
В случае вторичных и третичных спиртов процесс протекает по правилу Зайцева.
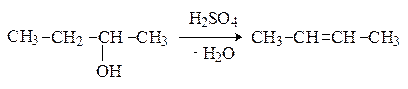
Дегидратация протекает преимущественно по механизму Е1 в соответствии со схемой:
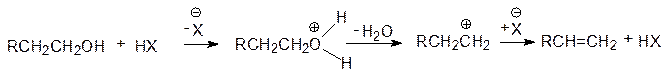
Х= 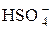
Атака аниона на промежуточно образующийся карбокатион может завершиться как отщеплением протона, так и присоединением к карбокатионному центру. Поэтому реакции дегидратации (элиминирования) протекают параллельно с образованием простых эфиров (нуклеофильным замещением). Склонность спиртов к дегидратации возрастает в ряду:
первичный < вторичный < третичный
Дегидратации способствует также высокая температура, например:
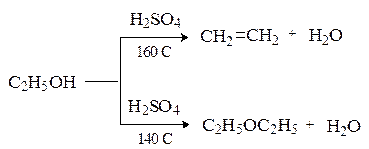
Окисление спиртов.Под окислением в органической химии понимают процессы, приводящие к обеднению субстрата водородом (дегидрирование) или к обогащению его кислородом. Окисление спиртов осуществляют при помощи двух основных приемов – дегидрирования и действия окислителей.
Дегидрирование
Первичные и вторичные спирты отщепляют водород при нагревании в присутствии медно-серебряного катализатора с образованием карбонильных соединений.
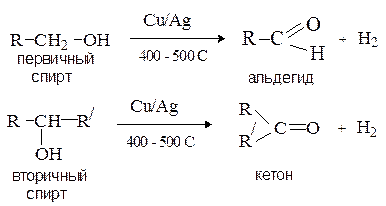
Третичные спирты в таких условиях не реагируют, а в более жестких – разрушаются.
Действие окислителей
Для окисления спиртов используют 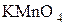 ,
, 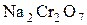 ,
, 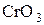 .
.
Первичные спирты окисляются до альдегидов, которые далее легко окисляются до карбоновых кислот.
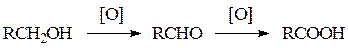
Реакцию можно остановить на стадии альдегида, если использовать кислый раствор дихромата натрия и отгонять образующийся альдегид из реакционной смеси:
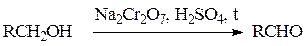
Вторичные спирты окисляются до кетонов под действием  или
или  .
.
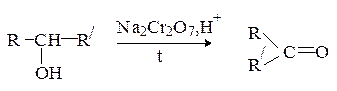
Окисление третичных спиртов протекает в жестких условиях и сопровождается деструкцией углеродного скелета.
| <== предыдущая страница | | | следующая страница ==> |
| Биологическая роль и применение в медицине | | | Многоатомные спирты |
Дата добавления: 2014-04-24; просмотров: 540; Нарушение авторских прав

Мы поможем в написании ваших работ!