
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Характеристика основных термодинамических параметров
Энтальпия определяет тепловой эффект процесса:
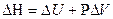 ,
,
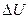 – внутренняя энергия;
– внутренняя энергия;
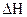 – свободная энергия.
– свободная энергия.
Энергия Гиббса указывает направление протекания процесса:
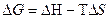
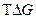 – связанная энергия.
– связанная энергия.
Чем больше разница между свободной и связанной энергиями, тем большую часть свободной энергии можно перевести в работу. Чем больше количество связанной энергии, тем меньшую часть можно перевести в работу. Таким образом, эта разница и количество связанной энергии может быть мерилом качества и концентрации энергии.
Энтропия – изменение теплоты процесса при изменении температуры.
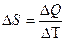
Чем больше приращение энтропии, тем меньшую часть энергии можно перевести в работу. Энтропия, определяющаяся стандартным образом, может характеризовать качество и концентрацию энергии. Если 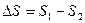 – положительное значение, т.е. энтропийный фактор высок, то количество связанной энергии высоко, количество свободной энергии мало – энергия низкокачественная и находится в рассеянной форме. Если приращение энтропии имеет отрицательное значение, то энтропийный фактор низок, количество связанной энергии мало, количество свободной энергии велико – энергия высококачественная и концентрированная.
– положительное значение, т.е. энтропийный фактор высок, то количество связанной энергии высоко, количество свободной энергии мало – энергия низкокачественная и находится в рассеянной форме. Если приращение энтропии имеет отрицательное значение, то энтропийный фактор низок, количество связанной энергии мало, количество свободной энергии велико – энергия высококачественная и концентрированная.
Уравнение Больцмана определяет энтропию через состояние к числу способов реализации этого состояния.
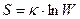
 Энтропия служит характеристикой упорядоченности системы. Чем более хаотично состояние системы, тем большее значение энтропии. Чем выше упорядоченность системы, тем меньше значение энтропии. Процессы, идущие с увеличением беспорядка, характеризуются положительным приращением энтропии. Процессы, идущие с увеличением упорядоченности, характеризуются отрицательным приращением энтропии.
Энтропия служит характеристикой упорядоченности системы. Чем более хаотично состояние системы, тем большее значение энтропии. Чем выше упорядоченность системы, тем меньше значение энтропии. Процессы, идущие с увеличением беспорядка, характеризуются положительным приращением энтропии. Процессы, идущие с увеличением упорядоченности, характеризуются отрицательным приращением энтропии.
Любые самопроизвольные процессы идут только в стороны беспорядка, упорядочности физические системы достигаются только путем приложения внешней работы. В случае если в системе проходят процессы ведущие к увеличению порядка, то значение энтропии уменьшается, а ее приращение имеет отрицательное значение. В случае если в системе проходят ведущие к хаосу значение энтропии увеличиваются, а ее приращение имеет достаточное положительное значение.
Таким образом, энтропийный фактор характеризует как степень упорядочности элементов в системе так и «качество» и «концентрацию» энергии, которая эта система может превратить в работу.
| <== предыдущая страница | | | следующая страница ==> |
| Принцип эмерджентности | | | Особенности проявления законов термодинамике при функционировании биосистем |
Дата добавления: 2014-08-09; просмотров: 341; Нарушение авторских прав

Мы поможем в написании ваших работ!