
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Тогда молярная масса газа равна
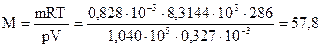 г/моль.
г/моль.
Пример 5. Определение давления газовой смеси.
В сосуде объемом 0,05 м3 при 250С содержится смесь из 0,020 м3 этилена под давлением 83 950 Па и 0,015 м3 метана под давлением 95 940 Па. Найдите общее давление газов в сосуде.
Решение. Сначала определяем парциальное давление каждого из газов:
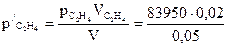 = 33 580 Па;
= 33 580 Па;
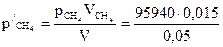 = 28 782 Па.
= 28 782 Па.
Общее давление газовой смеси равно сумме парциальных давлений газов: робщ = 33 580 + 28 782 = 62 362 Па.
3.3 Задания для контрольной работы.
Решить задачи.
41. При 17 0С некоторое количество газа занимает объем 580 мл. Какой объем займет это же количество при 1000С, если давление его останется неизменным?
42. При 27 0С и давлении 720 мм рт. ст. объем газа равен 5 л. Какой объем займет это же количество при 390С и давлении 104 кПа?
43. При 7 0С давление газа в закрытом сосуде равно 96,0 кПа. Каким станет давление, если охладить сосуд до -330С?
44. Давление газа в закрытом сосуде при 120С равно 100 кПа (750 мм рт. ст). Каким станет давление газа, если нагреть сосуд до 300С?
45. Температура азот, находящегося в стальном баллоне под давлением 12,5 МПа, равна 170С. Предельное давление для баллона 20,3 МПа. При какой температуре давление азота достигнет предельного значения?
46. При давлении 98,7 кПа и температуре 910С некоторое количество газа занимает объем 680 мл. Найти объем газа при нормальных условиях.
47. Вычислить массу 2 л H2 при 150С и давлении 100,7 кПа (755 мм рт. ст.)
48. Вычислить массу 1 м3 N2 при 100С и давлении 102,9 кПа (772 мм рт ст.)
49. Вычислить массу 0,5 м3 Cl2 при 20 0С и давлении 99,9 кПа (749,3 мм рт ст)
50. Бертолетова соль при нагревании разлагается с образованием KCl и O2. Сколько литров кислорода при 00С и давлении 101,3 кПа можно получить из 1 моль KClO3?
51. Сколько моль содержится в 1 м3 любого газа при нормальных условиях?
52. Сколько молекул содержится в 1,00 мл водорода при нормальных условиях?
53. Какой объем при нормальных условиях занимают 27*1021 молекул газа?
54. Сколько молекул диоксида углерода находится в 1 л воздуха, если объемное содержание CO2 cоставляет 0,03% (условия нормальные).
55. Какой объем Н2 (при 170С и давлении 102,4 кПа) выделится при растворении 1,5г цинка в соляной кислоте?
56. Какой объем углекислого газа получится при сгорании 2л бутана? Объемы обоих газов измерены при одинаковых условиях.
57. Плотность этилена по кислороду равна 0,875. Определить молекулярную массу газа.
58. При некоторой температуре плотность паров серы по азоту равна 9,14. Из скольких атомов состоит молекула серы при этой температуре?
59. Вычислить молекулярную массу ацетона, если масса 500мл его паров при 870С и давлении 96 кПа (720 мм рт ст) равна 0,93г.
60.Масса 200 мл ацетилена при нормальных условиях равна 0,232г. Определить молярную массу ацетилена.
4. ХИМИЧЕСКИЙ ЭКВИВАЛЕНТ.
4.1. Закон эквивалентов. Отношение масс (или объёмов) взаимодействующих друг с другом веществ прямо пропорционально их эквивалентным массам (объёмам). Математически это можно записать следующим образом:
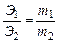 , где Э1,Э2 – эквиваленты (эквивалентные массы) элементов; m1,m2 – реальные массы (не мольные массы) веществ, например в граммах.
, где Э1,Э2 – эквиваленты (эквивалентные массы) элементов; m1,m2 – реальные массы (не мольные массы) веществ, например в граммах.
Под эквивалентом элемента понимают такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Масса 1 эквивалента элемента называется его эквивалентной массой. Эквивалент водорода ЭН всегда равен 1, а эквивалент кислорода ЭО=8.
Эквивалент элемента равен: Эм= 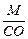 , где: М – мольная масса элемента; СО – степень окисления элемента (валентность) в соединении.
, где: М – мольная масса элемента; СО – степень окисления элемента (валентность) в соединении.
Эквивалент оксида равен: Эм= 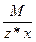 , где: М – мольная масса оксида; z – валентность кислорода; х – количество атомов кислорода в соединении.
, где: М – мольная масса оксида; z – валентность кислорода; х – количество атомов кислорода в соединении.
Эквивалент кислоты равен: Эм= 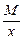 , где: М – мольная масса кислоты; х – основность кислоты (количество атомов водорода в кислоте)
, где: М – мольная масса кислоты; х – основность кислоты (количество атомов водорода в кислоте)
Эквивалент основания равен: Эм= 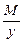 , где: М – мольная масса основания; у – кислотность основания (количество гидроксогрупп)
, где: М – мольная масса основания; у – кислотность основания (количество гидроксогрупп)
Эквивалент соли равен: Эм= 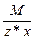 , где: М – мольная масса соли; z – валентность кислотного остатка; х – количество кислотных остатков в соединении.
, где: М – мольная масса соли; z – валентность кислотного остатка; х – количество кислотных остатков в соединении.
Примеры: эквивалент кислорода равен: Эо= 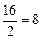 г-экв; эквивалент угольной кислоты Н2СО3 равен: ЭН2СО3=
г-экв; эквивалент угольной кислоты Н2СО3 равен: ЭН2СО3= 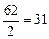 г-экв; эквивалент едкого натра NaOH равен: ЭNaOH=
г-экв; эквивалент едкого натра NaOH равен: ЭNaOH= 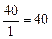 г-экв; эквивалент хлорида кальция CaCl2 равен: ЭCaCl2=
г-экв; эквивалент хлорида кальция CaCl2 равен: ЭCaCl2= 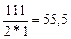 г-экв.
г-экв.
4.2. Задания для контрольной работы.
1.Рассчитать эквивалент химических соединений
| № варианта | Класс соединений |
| Оксид кадмия (II),оксид теллура (IV), гидроксид лития, сероводородная кислота, перманганат калия | |
| 62. | Оксид меди (I), оксид хлора (V), гидроксид магния, хлороводородная кислота, карбонат алюминия |
| 63. | Оксид кобальта (III), оксид бериллия, гидроксид рубидия, йодоводородная кислота, гипохлорит натрия |
| 64. | Оксид железа (II), оксид азота (V), гидроксид стронция, бромоводородная кислота, сульфат меди (II) |
| 65. | Оксид марганца (IV), оксид германия (II), гидроксид олова (II), Селеноводородная кислота, нитрат бария |
| Оксид молибдена (VI), оксид углерода (II), гидроксид золота (III), Фтороводородная кислота, гидрокарбонат магния | |
| Оксид хрома (III), оксид бора, гидроксид аммония, уксусная кислота, хлорат кальция | |
| Оксид титана (IV), оксид натрия, гидроксид хрома (III), муравьиная кислота, сульфит железа (II). | |
| Оксид ванадия (V), оксид олова (IV), гидроксид железа (II),серная кислота, цианид калия | |
| Оксид скандия (III), оксид брома (VII), гидроксид таллия (I), сернистая кислота, гидрокарбонат кальция | |
| Оксид ксенона (VIII), оксид сурьмы(V), гидроксид меди (II), кремниевая кислота, ацетат цинка |
Продолжение таблицы 4.2
| Оксид цинка (II), оксид селена (VI), гидроксид марганца (IV) , азотная кислота, хлорид натрия | |
| Оксид никеля (IV), оксид фосфора (III), гидроксид цинка, мышьяковая кислота, формиат бария | |
| Оксид хрома (VI), оксид мышьяка (V), гидроксид бария, угольная кислота, дихромат калия | |
| Оксид золота (III), оксид сурьмы (V), гидроксид никеля(II), ортофосфорная кислота, фторид алюминия | |
| оксид хрома (VI), оксид фосфора (III), гидроксид кобальта (II), мышьяковистая кислота, йодид никеля(II) | |
| оксид углерода (IV), оксид марганца (VII), гидроксид аммония, фтороводородная кислота, силикат калия | |
| Оксид йода(I), оксид калия, гидроксид кальция, марганцевая кислота, карбонат алюминия. | |
| оксида хрома(VI), азотистая кислота, гидроксид марганци(II), хлорноватистая кислота, сульфата олова(II). | |
| Оксида азота(III), оксид цезия, гидроксид бария, тиосерная кислота, сульфита стронция. |
5. СТРОЕНИЕ АТОМА. ПЕРИОДИЧЕСКИЙ ЗАКОН И ПРИОДИЧЕСКАЯ ТАБЛИЦА Д.И. МЕНДЕЛЕЕВА.
5.1. Атом и его строение
Атом любого элемента состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов, в целом же атом – система электронейтральная. Атомное ядро состоит из нуклонов: протонов (заряд +1, массовое число 1) и нейтронов (заряд 0, массовое число 1). Заряд ядра, равный порядковому номеру элемента в таблице Д.И. Менделеева, совпадает с числом протонов: массовое число ядра равно суммарному количеству протонов и нейтронов. У одного элемента возможно существование атомов с различным массовым числом ядер – изотопов, т.е. атомов с различным числом нейтронов и одинаковым числом протонов.
Согласно современным представлениям, электрон обладает одновременно свойствами волны и частицы,
Основные положения состояния электрона в атоме Н. Бор сформулировал в виде следующих постулатов:
1) электрон может вращаться вокруг ядра только по некоторым определенным круговым орбитам (стационарным орбитам);
2) Двигаясь по стационарной орбите, электрон не излучает электромагнитной энергии;
3) Излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую.
Строение атомов выражается электронной и электронно-графической формулой.
Например, строение атома фтора выражается электронной формулой 1s22s22p5 и электронно-графической формулой:
2s 2p
| 1s | ¯ | ¯ | ¯ | | ||
| ¯ | ||||||
Состояние электрона в атоме характеризуется волновой функцией, являющейся решением волнового уравнения Шредингера. Из математического анализа уравнения вытекает дискретность значений энергии электрона, момента количества орбитального движения и проекции этого момента на выделенное в пространстве направление. Дискретность выражается квантовыми числами: главным – n, орбитальным – l, магнитным - ml . Четвёртое квантовое число - ms, называют спиновым. Волновая функция при определённых значениях трёх квантовых чисел (n, l ,ml) описывает состояние электрона, характеризующееся так называемой атомной орбиталью (АО).
Каждой АО соответствует область пространства определённого размера, формы и ориентации, равноценная понятию электронного облака. Электронное облако не имеет чётких границ, в связи с этим введено понятие граничная поверхность, т.е. поверхность с равной электронной плотностью, ограничивающая объём, который включает 90% заряда и массы электрона. Форма и размер граничной поверхности считается формой и размером электронного облака.
Главное квантовое число – n определяет энергию АО и номер энергетического уровня, на котором находится электрон (т.е. допустимые уровни энергии электрона) и может принимать значения от единицы до бесконечности.
Орбитальное квантовое число – 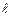 определяет форму АО и энергетический подуровень (т.е. квантование вытянутости эллиптической орбиты) и может принимать значения от нуля до n-
определяет форму АО и энергетический подуровень (т.е. квантование вытянутости эллиптической орбиты) и может принимать значения от нуля до n- 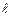 .
.
Магнитное квантовое число – ml определяет пространственную ориентацию данной АО и отчасти её форму (т.е. ориентацию электронных облаков в пространстве) и может принимать значения от – 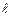 …0…+
…0…+ 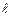 .
.
Спиновое квантовое число – ms характеризует собственный момент импульса и связанный с ним магнитный момент (т.е. вращение электрона вокруг оси), и может принимать значения ± 1/2.
Число АО в пределах энергетического подуровня определяется числовым значением магнитного квантового числа (2 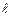 +1). Число АО в пределах всего энергетического уровня равно сумме АО всех его подуровней.
+1). Число АО в пределах всего энергетического уровня равно сумме АО всех его подуровней.
При заполнении атомных орбиталей действует принцип Паули (или запрет Паули), согласно которому в атоме не может быть двух электронов, у которых все четыре квантовых числа одинаковые. Основным следствием этого принципа является то, что на одной атомной орбитали не может находиться более двух электронов. Состояние электронов в атоме должно отличаться значением хотя бы одного квантового числа. При переходах электронов с одной орбиты на другую атом поглощает или излучает энергию.
Принцип Паули определяет ёмкость (максимальное число электронов) энергетических уровней и подуровней, которая соответственно равна 2n2 и 2(2 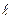 +1) т.е. удвоенному числу АО.
+1) т.е. удвоенному числу АО.
Заполнение энергетических подуровней подчиняется правилу Хунда, согласно которому устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. Например, четыре валентных p – электрона атома кислорода размещаются в квантовых ячейках следующим образом:
2p
| ¯ | | |
Закономерная последовательность заполнения энергетических уровней и подуровней в атомах с увеличением порядкового номера элемента выражается правилами Клечковкого, которые называют правилом суммы n+ 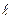 . Согласно I-му правилу Клечковского, при росте заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел к орбиталям с большим значением этой суммы. При одинаковом значении этой суммы порядок заполнения электронами энергетических подуровней определяется II-ым правилом Клечковского: при одинаковых значениях суммы главного и орбитального квантовых чисел заполнение орбиталей происходит последовательно в направлении возрастания значения главного квантового числа. Т.о. первым заполняется подуровень с меньшим значением n в этой сумме:
. Согласно I-му правилу Клечковского, при росте заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел к орбиталям с большим значением этой суммы. При одинаковом значении этой суммы порядок заполнения электронами энергетических подуровней определяется II-ым правилом Клечковского: при одинаковых значениях суммы главного и орбитального квантовых чисел заполнение орбиталей происходит последовательно в направлении возрастания значения главного квантового числа. Т.о. первым заполняется подуровень с меньшим значением n в этой сумме:
1 s ® 2 s ® 2 p ® 3 s ® 3 p ® 4 s ® 3 d ® 4 p ® 5 s ®
4 d ® 5 p ® 6 s ® …
Правила Клечковского позволяют заранее предвидеть появление в периодической системе Д.И. Менделеева рядов из d - , а затем из f - элементов, которые находятся между s – и p – элементами больших периодов.
Если на валентных энергетических уровнях имеются вакантные АО, то при возбуждении атома (получении ими порции энергии) становится возможным «разъединение» валентных электронов, то есть их переходы с тех подуровней, где все АО заняты полностью ( ¯) или частично (¯) на другие валентные подуровни того же уровня, имеющие незаполненные АО. При этом с тех АО, которые в основном (соответствующем минимальной энергии атома) состоянии были заняты полностью, «уходит» по одному электрону последовательно, т.е. возможно несколько возбуждённых состояний. Возбуждение меняет валентное состояние атома (число его неспаренных электронов). Например, валентными электронами атома осмия в основном состоянии являются следующее: 5d6 6s2. Их распределение по квантовым ячейкам:
5d 6s
| ¯ | | | | | ¯ |
(атом осмия находится в 4–валентном состоянии).
При этом как на пятом, так и на шестом уровнях имеются вакантные АО. Получение атомом осмия двух последовательных порций энергии приводит к следующим возбуждённым состояниям - атом осмия находится: 1) в шести валентном состоянии; 2) в 8 – валентном состоянии.
1869 Г. Д.И.Менделеев впервые сформулировал периодический закон. Данные о строении ядра и распределении электронов в атоме позволили дать новую формулировку закона:
Свойство простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядра атома.
Периодически таблица - есть график, отображения периодического закона.
5.2. Периодические свойства элементов.
1. Атомный радиус. Атомный радиус зависит от заряда ядра, т.е. с увеличением заряда ядра радиус уменьшается, т.к. увеличивается притяжение электронов внешнего слоя к ядру.
В периоде радиус атома, с увеличением порядкового номера, уменьшается.
В группе с увеличением порядкового номера радиус атома увеличивается.
2. Энергия ионизации. Потенциал ионизации.
Электроны наружного уровня могут присоединяться и отрываться, т. е. атомы могут стать положительно или отрицательно заряженными ионами.
 -
-

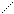 Атом – е Kt+
Атом – е Kt+
-

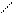
 Атом +е An-
Атом +е An-
Энергия необходимая для отрывания электрона от атома – называется энергией ионизации. Наименьшее напряжение электрического поля, при котором скорость электронов становится достаточной для ионизации атомов - называется потенциалом ионизации. Измеряется в ВОЛЬТАХ. ε- потенциал.
Первый потенциал меньше, чем второй, а второй меньше, чем третий и т. д.
Чем меньше потенциал ионизации, тем сильней выражены металлические свойства.
3. Cродство к электрону – это энергия, выделяющаяся при присоединении электрона к атому.
Сродство к электрону у металлов приблизительно равно 0, т. е. для атома металлов присоединение электрона не характерно и энергией не выгодно. Сродство к электрону для неметаллов положительно, тем больше, чем ближе к благородному газу находится неметалл.
4. Электроотрицательность.
Электроотрицательность - это способность атомов смещать электронную плотность в химической связи.
Открыта в 1932 году Л.ПОЛИНГОМ.
Электроотрицательность - это арифметическая сумма энергии ионизации и сродства к электрону(Х)
При расчетах используются относительные значения электроотрицательности:
X = 1
Li
X = 4 (max значение)
F
Условная граница между металлами и неметаллами определяется значением электроотрицательности.
X ≈ 2
Если X ‹ 2 металл, если X > 2 неметалл.
Периодически изменяются следующие свойства атомов:
Радиус атома,
потенциал ионизации,
сродство к электрону,
степень окисления.
Непериодически ( монотонно ) изменяются:
Масса атомов,
число электронов в атоме.
Периодичность изменений химических и физических свойств элементов главных подгрупп.
| Свойства | Изменения | |
| в главных подгруппах | в периодах | |
| Заряд ядра | Возраст ↓ | Возраст → |
| Радиус атома | Возраст ↓ | Возраст → |
| Высшая валентность по водороду | Пост | Возраст I - VII |
| Потенциал ионизации | Возраст ↑ | Возраст → |
| Сродство к электрону | Возраст ↑ | Возраст → |
| Электроотрицательность | В основ возраст ↑ | Возраст → |
| Не металлические | Возраст ↑ | Возраст → |
| Металлические | Возраст ↓ | Возраст ↓ |
| Плотность простых вещ | Возраст → | I→IV←VII |
| t плавления и кипения металлов | Возраст ↑ | |
| t плавления и кипения неметаллов | Возраст ↓ |
5.3. Задания для контрольной работы.
81.Запишите распределение электронов по квантовым ячейкам электронов у элементов №50, №73. Укажите семейство элементов, электронную формулу. Укажите валентность, степень окисления
82.У какого из р-элементов пятой группы – фосфора или сурьмы – сильнее выражены неметаллические свойства? Какое из водородных соединений данных элементов более сильный окислитель?
83.Запишите распределение электронов по квантовым ячейкам электронов у элементов №38, №75. Укажите семейство элементов, электронную формулу. Укажите валентность, степень окисления
84.У какого из элементов четвертого периода – хрома или селена – сильнее выражены металлические свойства? Какой из элементов образует газообразное соединение с водородом?
85.Запишите распределение электронов по квантовым ячейкам электронов у элементов №34, Укажите семейство элементов, электронную формулу. Укажите валентность, степень окисления
86.Запишите распределение электронов по квантовым ячейкам электронов у элементов №55, Укажите семейство элементов, электронную формулу. Укажите валентность, степень окисления
87.Какую низшую степень окисления проявляют водород, фтор, сера и азот? Почему? Составьте формулы соединения кальция с данными элементами в этой степени окисления
88.Запишите распределение электронов по квантовым ячейкам электронов у элементов №47, №35. Укажите семейство элементов, электронную формулу. Укажите валентность, степень окисления
89.Какую низшую и высшую степени окисления проявляют кремний, мышьяк, селен, хлор? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
90.Какую низшую и высшую степени окисления проявляют углерод, фосфор, сера, йод? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
91. Запишите распределение электронов по квантовым ячейкам электронов у элементов №35, №48. Укажите семейство элементов, электронную формулу. Укажите валентность, степень окисления
92.Какова современная формулировка периодического закона? Объясните, почему в периодической системе элементов аргон, кобальт, теллур и торий помещены, соответственно, перед калием, никелем, йодом и протактинием, хотя имеют большую атомную массу?
93.Каким из перечисленных атомов и ионов Mg0, Cl-, Cu+2, Ar0, Cu0 отвечает электронная формула 1s22s22p63s23p6?
94.Расположите элементы в порядке возрастания электроотрицательности N, B, F, As, I. Какому атому или иону As0, Kr0,As-3, Mn+2 соответствует электронная формула 1s22s22p63s23p63d104s24p6?
95.Исходя из положения кислотообразующего элемента в периодической системе, определите, какая кислота сильнее: серная или хлорная? Напишите их формулы.
96.Какие из перечисленных элементов K, S, Co, Cu, U, Mg, Mo, Cs относятся к s-семейству? Напишите электронные формулы их атомов.
97.Исходя из положения кальция и железа в периодической системе, определите, какое основание сильнее Ca(OH)2 или Fe(OH)2?
98.Марганец образует соединения, в которых проявляет степени окисления +2,+3,+4,+6,+7. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления.
99 Каким из перечисленных атомов или ионов S-2, Al0, K+, P0 , Cl0 и Ar0 отвечает электронная формула 1s22s22p63s23p5
100. Электронная формула элемента имеет окончание ….3d6 4s2. Определите элемент, напишите его электронную формулу.
| <== предыдущая страница | | | следующая страница ==> |
| ХИМИЧЕСКАЯ СИМВОЛИКА КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ | | | ТЕРМОДИНАМИКА И ТЕРМОХИМИЯ |
Дата добавления: 2014-09-08; просмотров: 681; Нарушение авторских прав

Мы поможем в написании ваших работ!