
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ХИМИЧЕСКАЯ СИМВОЛИКА КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
2.1. Химическая символика
Любой химический символ имеет двойной смысл: 1) обозначает атом или молекулу; 2) обозначает атомную или молекулярную массу. Поэтому из химической формулы и из химического уравнения вытекает два вывода: качественный и количественный.
В химии принято атом (химический элемент) обозначать химическим знаком, молекулу – химической формулой, схему химического превращения одних веществ в другие – уравнения химических реакций.
Химический знак – обозначают первыми (одной или двумя) буквами латинского названия элемента.
П р и м е р: H – Hydrogenium – водород, N – Nytrogenium – азот, Au – Aurum – золото.
Известно более 120 химических элементов. Каждый элемент имеет знак и место в таблице – «клетку». «Клетка» имеет свой номер и, кроме того, соответствует определенному номеру вертикального столбца – группы и номеру горизонтального периода
2.2. Классификация неорганических соединений по функциональным признакам и составу.
Химические вещества (по составу)
 |  |


 Простые Сложные
Простые Сложные
металлы бинарные трехатомные
неметаллы
амфотерные элмененты
Al, Zn
Количество атомов в составе сложной молекулы указываются индексами (единица не записывается в составе молекулы)
LiH - 1 атом лития, 1 атом водорода
SO3 – 1 атом серы, 3 атома кислорода
Если в молекуле имеются скобки, то количество атомов увеличивается.
Al2(SO4)3 – 2 атома алюминия, 2 атома серы, 12 атомов кислорода.
Значения индексов зависят от валентности элементов и групп, входящих в состав молекулы.
Классификация сложных неорганических веществ по составу:
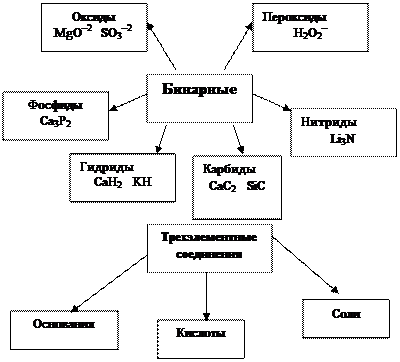 |
2. Оксиды. Классификация. Свойства. Получение.
Оксиды – сложные вещества, состоящие из двух элементов один из которых кислород (Валентность -II, степень окисления -2).
H2O H-O-H
+H : O-2 : H+
Существуют солеобразующие и несолеобразующие оксиды.
Номенклатура оксидов
Слово “оксид” + “название элемента” + валентность
SO2 - оксид серы (IV) - (SIVO2II)
К несолеобразующим оксидам относят оксиды, которые не образуют солей (CO, NO).
Существуют 3 группы оксидов:
- основные
-кислотные
-амфотерные
Основные
К основным оксидам относят оксиды типичных металлов.
Получение
1) Окисление металлов (кроме металлов1-А гр.)
2Са+О2 → 2СаО
2) Обжиг сульфидов
FeS + O2 →t Fe2O3 + SO2
основной и кислотный оксиды
3) Разложение гидроксидов тяжелых металлов
Cu (OH)2 →t CuO + H2O
основной и амфотерный оксид
4) Разложение солей (особенно карбонатов и нитратов)
CaCO3 –t CaO+CO2↑
Химические свойства
1.Основные оксиды взаимодействуют с кислотными оксидами
BaO+SiO2 → BaSiO3
2.Взаимодействуют с амфотерными оксидами
MgO+Al2O3 → Mg(AlO2)2
3.Взаимодействуют с кислотами
CaO+H2SO4 → CaSO4+H2O
4.Взаимодействуют с водой
CaO+H2O →Ca(OH)2
5.Участвуют в ОВР
Fe+32O-23+Al0 → Al+32O-2+Fe0
Кислотные
Кислотные оксиды – оксиды неметаллов или переходных металлов в высшей степени валентности
Mn+2 Mn+4 Mn+7
основной амфотерный кислотный
Способы получения
а)окисление неметаллов
С+О2 → t СО2
б)смотри способы 2 и 4
Номенклатура
Наряду с современной номенклатурой для кислотных оксидов используется старинная система названий ангидридов кислот.
Ангидрид – продукт отщепления воды от соответствующей кислоты
Химические свойства
1.кислотные оксиды взаимодействуют с водой и образованиями кислот
SO3+H2O →H2SO4
2.взаимодействуют с амфотерными оксидами
P2O5+Al2O3 → 2AlPO4
3.взаимодействуют с основаниями
CO2+Ca(OH)2 →CaCO3+H2O
4.участвуют в ОВР
2SO2+O2 → t 2SO3
Амфотерные
Амфотерные оксиды сочетают свойства основных и кислотных оксидов.
Al2O3+6HCl →2AlCl3+3H2O
Al2O3+NaOH+H2O → Na[Al(OH)4]
H2O – идеальный амфотерный оксид
2. 3. Кислоты. Классификация. Свойства. Получение.
Кислоты сложные вещества, содержащие один, или несколько атомов водорода, способных полностью, или частично замещаться на атом металла. В растворах кислоты имеют рН менее 7.
Индикатор лакмус изменяет окраску на красный; фенолфталеин - бесцветный; метилоранжевый - на розовый.
Существует несколько классификаций кислот:
КИСЛОТЫ
↓ ↓
Бескислородные Кислородосодержащие
HI, HBr, H2S. H2SO3, HClO2
КИСЛОТЫ
↓ ↓ ↓
Одноосновные Двухосновные Многоосновные
HCl, HNO3 H2S, H2SO4 H3PO4
НОМЕНКЛАТУРА:
Многие кислоты сохранили историческое название, например, соляная кислота HCl, плавиковая кислота HF.
Название кислородных кислот происходит от названия неметалла с добавлением –ная- и -вая- , если степень окисления неметалла максимальная:
+6
H2SO4 –максимальное - серная кислота
+5
H3AsO4 – максимальное - мышьяковая кислота
По мере понижения степени окисления суффикс меняется в следующем порядке –оватая- , -истая-, -оватистая-.
+7
HClO4 – хлорная
+5
HClO3 - хлорноватая
+3
HClO2 - хлористая
+1
HClO – хлорноватистая
ПОЛУЧЕНИЕ
1) Бескислородные кислоты: получают методом прямого синтеза.
Cl2 + H2→2HCl
2) Действием более сильных кислот на соответствующие соли
FeS+2HCl→ H2S↑+FeCl2
3) Взаимодействие кислотных оксидов и воды
SO3+ H2O→H2SO4
ХИМИЧЕСКИЕ СВОЙСТВА.
1) Взаимодействие кислот с активными металлами
HCl+Zn→ZCl2+H2↑
2) C основными оксидами
H2SO4+CaO→CaSO4+H2O
3) Взаимодействие кислот с основаниями
H3PO4+3NaOH→Na3PO4+3H2O
4) Взаимодействие кислот с амфотерными оксидами
6HCl+Al2O3→2AlCl3+3H2O
5) Взаимодействие кислот с солями
H2SO4+BaCl2→BaSO4↓+HCl – реакция возможна, если продукт выделяется газом, или выпадает в осадок.
2.4 Основания.
Основания – это сложные вещества, состоящие из атомов металла и одой или нескольких гидроксильных групп.
Названия образуют с помощью слова <гидроксид>, к которому добавляется название металла в родительном падеже. Для гидроксидов металлов с переменной валентностью ее следует указать.
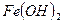 - гидроксид железа (II)
- гидроксид железа (II)
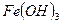 - гидроксид железа (III)
- гидроксид железа (III)
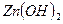 - гидроксид цинка
- гидроксид цинка
2.5. Соли.
Соли – продукт полного или частичного замещения атомов водорода в молекуле кислоты на металл или же продукт полного или частичного замещения группы ОН- в основании на кислотный остаток.
Соли:
1) Средние (NaCl, Na2SO4, Fe3(PO4)2).
2) Кислые (NaHCO3, Ca(HSO4)2, Fe(HPO4)3 ).
3) Основные (FeOHCl, (CaOH)2SO4).
4) Двойные (CaCO3* MgCO3).
5) Смешанные (Na3CO3(HCO3)).
6) Комплексные (K4[Fe(CN)6]).
Номенклатура:
1) средние соли
кислотный остаток + название Ме (валентность Ме).
Fe2(SO4)3
Сульфат железа (III)
2) кислые соли
гидро + кислотный остаток + название Ме (валентность Ме).
NaHSO4 – гидросульфат Na.
Fe(H2PO4)2 – дигидрофостфат Fe(II).
3) основные соли
кислотный остаток + гидроксо + Ме (валентность Ме).
CaOHCl
Хлорид гидроксокальция
(Al(OH)2)2SO4
сульфат дигидроксоалюминия
4) двойные соли
кислотный остаток + Ме + Ме
KAl(SO4)2 – сульфаталлюминия-калия
5) смешанные соли
Na3CO3(HCO3) – гидрокарбонат-карбонат натрия
6) комплексные соли
K4[Fe(CN)6] – гексоцианоферрат(III) калия
Получение:
1) метод прямого синтеза
Mg + Cl2 → MgCl2
2) активный Ме + кислота
Mg + 2HCl → MgCl2 + H2↑
3) малоактивный Ме с концентрированными кислотами (H2SO4 + HNO3).
Cu + H2SO4 (k) → CaSO4 + SO2↑+ H2O
4) основной оксид + кислота
CaO + 2HCl → CaCl2 + H2O
5) основание + кислота
Ca(OH)2 + HCl → CaCl2 + H2O
6) основной оксид + кислотный оксид
CaO + CO2 → CaCO3
7) основание + кислотный оксид
Ca(OH)2 + CO2 → CaCO3 + H2O
8) основание + кислота
Ca(OH)2 + H2SO4 → CaSO4 + 2H2O
9) соль + кислота
Na2SiO3 + HCl → NaCl + H2SiO3↓
10) соль + основание
CuSO4 + 2NaOH→ Cu(OH)2↓ + Na2SO4
11) соль + соль
AgNO3 + NaCl → AgCl↓ + NaNO3
Химические свойства:
Соли взаимодействуют с Ме, кислотами, основаниями и между собой (уравнения реакций смотрите выше).
При нагревании соли аммония, малоактивных Ме, слабых кислот и кислот, в которых элементы проявляют максимальную валентность, разлагаются.
NH4Cl → NH3↑ + HCl
Хлорид аммония
AgNO3 → Ag + O2 + NO2
CaCO3 → CaO + CO2↑
KNO3 → KNO2 + O2
Генетическая связь основных классов неорганических соединений.
−−−−−−−−Элементы −−−−−−−−−−
↓ ↓ ↓
Ме амфотерные элементы неМе
↓ ↓ ↓
осн.оксиды амфотерные оксиды кислот.оксиды
↓ ↓ ↓
основания амфотерные гидроксиды кислоты
↓ ↓ ↓
соли
2.6. Задания для контрольной работы.
2.6.1. Запишите молекулярные формулы химических соединений и укажите число элементов, входящих в состав молекулы, количество атомов в молекуле.
Таблица 2.6.1
| № варианта | Класс соединений |
| Оксид кадмия (II),оксид теллура (IV), гидроксид лития, сероводородная кислота, перманганат калия | |
| 2. | Оксид меди (I), оксид хлора (V), гидроксид магния, хлороводородная кислота, карбонат алюминия |
| 3. | Оксид кобальта (III), оксид бериллия, гидроксид рубидия, йодоводородная кислота, гипохлорит натрия |
| 4. | Оксид железа (II), оксид азота (V), гидроксид стронция, бромоводородная кислота, сульфат меди (II) |
| 5. | Оксид марганца (IV), оксид германия (II), гидроксид олова (II), Селеноводородная кислота, нитрат бария |
| Оксид молибдена (VI), оксид углерода (II), гидроксид золота (III), Фтороводородная кислота, гидрокарбонат магния | |
| Оксид хрома (III), оксид бора, гидроксид аммония, уксусная кислота, хлорат кальция | |
| Оксид титана (IV), оксид натрия, гидроксид хрома (III), муравьиная кислота, сульфит железа (II). | |
| Оксид ванадия (V), оксид олова (IV), гидроксид железа (II),серная кислота, цианид калия | |
| Оксид скандия (III), оксид брома (VII), гидроксид таллия (I), сернистая кислота, гидрокарбонат кальция | |
| Оксид ксенона (VIII), оксид сурьмы(V), гидроксид меди (II), кремниевая кислота, ацетат цинка | |
| Оксид цинка (II), оксид селена (VI), гидроксид марганца (IV) , азотная кислота, хлорид натрия | |
| Оксид никеля (IV), оксид фосфора (III), гидроксид цинка, мышьяковая кислота, формиат бария | |
| Оксид хрома (VI), оксид мышьяка (V), гидроксид бария, угольная кислота, дихромат калия | |
| Оксид золота (III), оксид сурьмы (V), гидроксид никеля(II), ортофосфорная кислота, фторид алюминия | |
| оксид хрома (VI), оксид фосфора (III), гидроксид кобальта (II), мышьяковистая кислота, йодид никеля(II) | |
| оксид углерода (IV), оксид марганца (VII), гидроксид аммония, фтороводородная кислота, силикат калия | |
| Оксид йода(I), оксид калия, гидроксид кальция, марганцевая кислота, карбонат алюминия. | |
| оксида хрома(VI), азотистая кислота, гидроксид марганци(II), хлорноватистая кислота, сульфата олова(II). | |
| Оксида азота(III), оксид цезия, гидроксид бария, тиосерная кислота, сульфита стронция. |
Таблица 2.6.2..Записать уравнения химических превращений, назвать согласно номенклатуре ИЮПАК все вещества.
| № варианта | Схема химических превращений |
| N2 → NH3→ NH4OH → NH4Cl → NH3 | |
| Al → Al2(SO)3 → Al(OH)3 →NaAlO2 | |
| Fe → FeSO4 → Fe(OH)2 → Fe(OH)3 → Fe2(SO4)3 | |
| Zn → ZnO → ZnCl2 → Zn(OH)2 → Na2ZnO2 | |
| Mg → MgO → MgCl2 → Mg(OH)2 → MgSO4 | |
| Ca → CaO → Ca(OH)2 → CaCO3 → Ca(HCO3)2 | |
| Fe → Fe2O3 → FeCl3 → Fe2(SO4)3 → Fe(OH)3 | |
| S → SO2 → SO3 → H2SO4 → (NH4)2SO4 → BaSO4 | |
| NaOH → Cu(OH)2 → CuO → Cu → CuO | |
| P → P2O5 → H3PO4 → Na2(HPO4)→ NaH2PO4 → Na3PO4 | |
| Cr2O3 → Cr(OH)3 → CrCl3 → Cr2S | |
| Cl2 → NaCl → ZnCl2 → Zn(OH)2 → ZnS | |
| Na2O → NaOH → NH3→ NH4Cl → AgCl | |
| Na → NaOH → NaCl → Na2SO4 → BaSO4 | |
| Ba → BaO → Ba(OH)2 → BaCO3 → BaO | |
| Zn → ZnCl2 → Zn(OH)2 → (ZnOH)2SO4 → ZnSO4 | |
| Fe(OH)3 → Fe2O3 → Fe2(SO4)3 → Fe(OH)3 →FeOHCl2 | |
| К→ К2O→ КOH→К2SO4→К2CO3→CO2 | |
| Si → SiO2 → Na2SiO3 → H2SiO3 → SiO2 | |
| H2 → H2O → NaOH → Na2CO3 → CO2→ H2CO3 |
3. ОСНОВНЫЕ ЗАКОНЫ ОБЩЕЙ ХИМИИ. СТЕХИОМЕТРИЯ.
3.1 Стехиометрия — раздел химии, в котором рассматриваются массовые или объемные соотношения между реагирующими веществами. Исключительное значение для развития химии имеют следующие стехиометрические законы.
1.Закон постоянства состава. Соотношение масс элементов, формирующих данное соединение, постоянно и не зависит от способа получения этого соединения.
2.Закон кратных отношений. Установлен Дальтоном в 1803г. В случае, когда два элемента образуют между собой несколько химических соединений, массы элементов относятся друг к другу как небольшие целые числа.
3.Моль. Закон Авогадро. Молярный объем газа.
 |
Моль (n) - кол-во вещества, содержащее столько структурных единиц (молекул, атомов, ионов и др.), сколько атомов содержится в 12 г (0,012 кг) изотопа углерода 12С 1моль вещества содержит 6,02*1023 структурных единиц (число Авогадро , NА)
Формулы, отражающие взаимосвязь объема вещества, его массы и молекулярной массы.
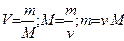 |
Где m-масса,M-молярная масса, V- объем.
4. Закон Авогадро. Установлен итальянским физиком Авогадро в 1811 г. Одинаковые объемы любых газов, отобранные при одной температуре и одинаковом давлении, содержат одно и тоже число молекул.
Таким образом, можно сформулировать понятие количества вещества: 1 моль вещества содержит число частиц, равное 6,02*1023 (называемое постоянной Авогадро)
Следствием этого закона является то, что 1 моль любого газа занимает при нормальных условиях (Р0 =101,3кПа и Т0=298К) объём, равный 22,4л.
5. Закон Бойля-Мариотта
При постоянной температуре объем данного количества газа обратно пропорционален давлению, под которым он находится:
PV = const.
6. Закон Гей-Люссака
При постоянном давлении изменение объема газа прямо пропорционально температуре:
V/T = const.
7. Зависимость между объемом газа, давлением и температурой можно выразить объединенным законом Бойля-Мариотта и Гей-Люссака, которым пользуются для приведения объемов газа от одних условий к другим :
P0, V0 ,T0-давление объема и температуры при нормальных условиях: P0=760 мм рт. ст. или 101,3 кПа ; T0=273 К (00С)
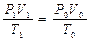
8. Независимая оценка значения молекулярной массы М может быть выполнена с использованием так называемого уравнения состояния идеального газа или уравнения Клапейрона-Менделеева:
pV=(m/M)*RT=vRT. (1.1)
где р — давление газа в замкнутой системе, V — объем системы, т — масса газа, Т — абсолютная температура, R —универсальная газовая постоянная.
Отметим, что значение постоянной R может быть получено подстановкой величин, характеризующих один моль газа при н.у., в уравнение (1.1):
r = (р V)/( Т)=(101,325кПа 22.4л)/(1 моль 273К)=8.31Дж/моль.К)
3.2. Примеры решения задач
Пример 1. Приведение объема газа к нормальным условиям.
Какой объем (н.у.) займут 0,4×10-3 м3 газа, находящиеся при 500С и давлении 0,954×105 Па?
Решение. Для приведения объема газа к нормальным условиям пользуются общей формулой, объединяющей законы Бойля-Мариотта и Гей-Люссака:
pV/T = p0V0/T0.
Объем газа (н.у.) равен 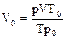 , где Т0 = 273 К; р0 = 1,013×105 Па; Т = 273 + 50 = 323 К;
, где Т0 = 273 К; р0 = 1,013×105 Па; Т = 273 + 50 = 323 К;
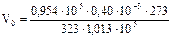 м3 = 0,32×10-3 м3.
м3 = 0,32×10-3 м3.
При (н.у.) газ занимает объем, равный 0,32×10-3 м3.
Пример 2. Вычисление относительной плотности газа по его молекулярной массе.
Вычислите плотность этана С2Н6 по водороду и воздуху.
Решение. Из закона Авогадро вытекает, что относительная плотность одного газа по другому равна отношению молекулярных масс (Мч) этих газов, т.е. D=М1/М2. Если М1 С2Н6 = 30, М2 Н2 = 2, средняя молекулярная масса воздуха равна 29, то относительная плотность этана по водороду равна DН2 = 30/2 =15.
Относительная плотность этана по воздуху: Dвозд = 30/29 = 1,03, т.е. этан в 15 раз тяжелее водорода и в 1,03 раза тяжелее воздуха.
Пример 3. Определение средней молекулярной массы смеси газов по относительной плотности.
Вычислите среднюю молекулярную массу смеси газов, состоящей из 80 % метана и 20 % кислорода (по объему), используя значения относительной плотности этих газов по водороду.
Решение. Часто вычисления производят по правилу смешения, которое заключается в том, что отношение объемов газов в двухкомпонентной газовой смеси обратно пропорционально разностям между плотностью смеси и плотностями газов, составляющих эту смесь. Обозначим относительную плотность газовой смеси по водороду через DН2. она будет больше плотности метана, но меньше плотности кислорода:
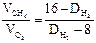 ;
;  ;
;
80DН2 – 640 = 320 – 20DН2 ; DН2 = 9,6.
Плотность этой смеси газов по водороду равна 9,6. средняя молекулярная масса газовой смеси МН2 = 2DН2 = 9,6×2 = 19,2.
Пример 4. Вычисление молярной массы газа.
Масса0,327×10-3 м3 газа при 130С и давлении 1,040×105 Па равна 0,828×10-3 кг. Вычислите молярную массу газа.
Решение. Вычислить молярную массу газа можно, используя уравнение Менделеева-Клапейрона:
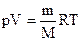 ,
,
где m – масса газа; М – молярная масса газа; R – молярная (универсальная) газовая постоянная, значение которой определяется принятыми единицами измерения.
Если давление измерять в Па, а объем в м3, то R=8,3144×103 Дж/(кмоль×К).
| <== предыдущая страница | | | следующая страница ==> |
| ПО ИЗУЧЕНИЮ ДИСЦИПЛИНЫ | | | Тогда молярная масса газа равна |
Дата добавления: 2014-09-08; просмотров: 819; Нарушение авторских прав

Мы поможем в написании ваших работ!