
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Электролиз
|
Читайте также: |
Электролизом называются окислительно-восстановительные реакции, протекающие на электродах в растворе или расплаве электролита под действием постоянного электрического тока, подаваемого от внешнего источника. При электролизе происходит превращение электрической энергии в химическую. Прибор, в котором проводят электролиз, называют электролизером. На отрицательном электроде электролизера (катоде) происходит процесс восстановления – присоединения окислителем электронов, поступающих из электрической цепи, а на положительном электроде (аноде) – процесс окисления – переход электронов от восстановителя в электрическую цепь.
Таким образом, распределение знаков заряда электродов противоположно тому, которое имеется при работе гальванического элемента. Причина этого заключается в том, что процессы, протекающие при электролизе, в принципе обратны процессам, идущим при работе гальванического элемента. При электролизе процессы осуществляются за счёт энергииэлектрического тока, подводимой извне, в то время как при работе гальванического элемента энергия самопроизвольно протекающей в нём химической реакции превращается в электрическую энергию. Для процеcсов электролиза DG>0, т.е. при стандартных условиях они самопроизвольно не идут.
 Электролиз расплавов. Рассмотрим электролиз расплава хлорида натрия (рис. 10.2). Это простейший случай электролиза, когда электролит состоит из одного вида катионов (Na+) и одного вида анионов(Cl
Электролиз расплавов. Рассмотрим электролиз расплава хлорида натрия (рис. 10.2). Это простейший случай электролиза, когда электролит состоит из одного вида катионов (Na+) и одного вида анионов(Cl  ) и никаких других частиц, могущих участвовать в электролизе, нет. Процесс электролиза расплава NaCl идёт следующим образом. С помощью внешнего источника тока электроны подводятся к одному из электродов, сообщая ему отрицательный заряд. Катионы Na+ под действием электрического поля движутся к отрицательному электроду, взаимодействуя с приходящими по внешней цепи электронами. Этот электрод является катодом, и на нём идёт процесс восстановления катионов Na+. Анионы Cl
) и никаких других частиц, могущих участвовать в электролизе, нет. Процесс электролиза расплава NaCl идёт следующим образом. С помощью внешнего источника тока электроны подводятся к одному из электродов, сообщая ему отрицательный заряд. Катионы Na+ под действием электрического поля движутся к отрицательному электроду, взаимодействуя с приходящими по внешней цепи электронами. Этот электрод является катодом, и на нём идёт процесс восстановления катионов Na+. Анионы Cl  движутся к положительному электроду и, отдав электроны аноду, окисляются. Процесс электролиза наглядно изображают схемой, которая показывает диссоциацию электролита, направление движения ионов, процессы на электродах и выделяющиеся вещества. Схема электролиза расплава хлорида натрия выглядит так:
движутся к положительному электроду и, отдав электроны аноду, окисляются. Процесс электролиза наглядно изображают схемой, которая показывает диссоциацию электролита, направление движения ионов, процессы на электродах и выделяющиеся вещества. Схема электролиза расплава хлорида натрия выглядит так:
NaCl = Na+ + Cl 
(-) Катод: Na+ Анод (+):Cl 
Na+ + e- = Na 2Cl  - 2eˉ = Cl2
- 2eˉ = Cl2
Суммарное уравнение:
 2Na+ + 2Cl
2Na+ + 2Cl  ЭЛЕКТРОЛИЗ 2Na + Cl2
ЭЛЕКТРОЛИЗ 2Na + Cl2
или в молекулярном виде
 2NaCl ЭЛЕКТРОЛИЗ 2Na + Cl2
2NaCl ЭЛЕКТРОЛИЗ 2Na + Cl2
Эта реакция является окислительно-восстановительной: на аноде протекает процесс окисления, на катоде – процесс восстановления.
В процессах электролиза растворов электролитов могут участвовать молекулы воды и имеет место поляризация электродов.
Поляризация и перенапряжение. Потенциалы электродов, определённые в растворах электролитов в условиях отсутствия в цепи электрического тока, называются равновесными потенциалами (в стандартных условиях – стандартные электродные потенциалы). При прохождении электрического тока потенциалы электродов изменяются. Изменение потенциала электрода при прохождении тока называется поляризацией:
Dj = j i - j р,
где Dj - поляризация;
j i – потенциал электрода при прохождении тока;
j р – равновесный потенциал электрода.
Когда известна причина изменения потенциала при прохождении тока вместо термина «поляризация», используют термин «перенапряжение». Его также относят к некоторым конкретным процессам, например, к катодному выделению водорода (водородное перенапряжение).
Для экспериментального определения поляризации строят кривую зависимости потенциала электрода от плотности тока, протекающего через электрод. Так как электроды могут быть разными по площади, то в зависимости от площади электрода при одном и том же потенциале могут быть разные токи; поэтому ток относят обычно к единице площади поверхности. Отношение тока I к площади электрода S называют плотностью тока I:
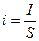 .
.
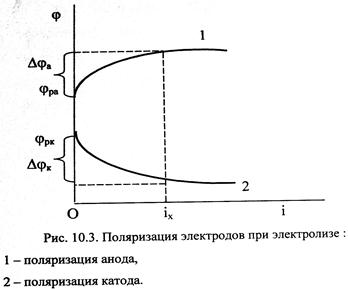 Графическую зависимость потенциала от плотности тока называют поляризационной кривой (рис. 10.3). При прохождении тока изменяются потенциалы электродов электролизёра, т.е. возникает электродная поляризация. Вследствие катодной поляризации (Djк) потенциал катода становится более отрицательным, а из-за анодной поляризации (Djа) потенциал анода становится более положительным.
Графическую зависимость потенциала от плотности тока называют поляризационной кривой (рис. 10.3). При прохождении тока изменяются потенциалы электродов электролизёра, т.е. возникает электродная поляризация. Вследствие катодной поляризации (Djк) потенциал катода становится более отрицательным, а из-за анодной поляризации (Djа) потенциал анода становится более положительным.
Последовательность электродных процессов при электролизе растворов электролитов.В процессах электролиза растворов электролитов могут участвовать молекулы воды, ионы Н+ и ОН  в зависимости от характера среды. При определении продуктов электролиза водных растворов электролитов можно в простейших случаях руководствоваться следующими соображениями:
в зависимости от характера среды. При определении продуктов электролиза водных растворов электролитов можно в простейших случаях руководствоваться следующими соображениями:
1. Катодные процессы.
1.1. На катоде в первую очередь идут процессы, характеризуемые наибольшим электродным потенциалом, т.е. в первую очередь восстанавливаются наиболее сильные окислители.
1.2. Катионы металлов, имеющих стандартный электродный потенциал больший, чем у водорода (Cu2+, Ag+ , Hg2+, Au3+ и др. катионы малоактивных металлов), при электролизе практически полностью восстанавливаются на катоде:
Men+ + neˉ " Me.
1.3. Катионы металлов, потенциал которых значительно меньше, чем у водорода (стоящих в «Ряду напряжений» от Li+ до Al3+ включительно, т.е. катионы активных металлов), не восстанавливаются на катоде, так как на катоде восстанавливаются молекулы воды:
2Н2О + 2еˉ ® Н2 + 2ОН  .
.
Электрохимическое выделение водорода из кислых растворов происходит вследствие разряда ионов водорода:
2Н+ + 2еˉ " Н2.
1.4. Катионы металлов, имеющих стандартный электродный потенциал, меньше, чем у водорода, но больше чем у алюминия (стоящих в «Ряду напряжений» от Al3+ до 2Н+ - катионы металлов средней активности), при электролизе на катоде восстанавливаются одновременно с молекулами воды:
Меn+ + neˉ ® Me
2Н2О + 2еˉ ® Н2 + 2ОН  .
.
К данной группе относятся ионы Sn2+, Pb2+, Ni2+, Co2+, Zn2+, Cd2+ и т.д.. При сравнении стандартных потенциалов этих ионов металлов и водорода можно было бы сделать вывод о невозможности выделения металлов на катоде. Однако следует учесть:
· стандартный потенциал водородного электрода относится к ан+  [Н+]
[Н+]  1 моль/л., т.е. рН=0; с увеличением рН потенциал водородного электрода уменьшается, становится отрицательнее (
1 моль/л., т.е. рН=0; с увеличением рН потенциал водородного электрода уменьшается, становится отрицательнее ( 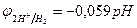 ; см. раздел 10.3); в то же время потенциалы металлов в области, где не происходит выпадения их нерастворимых гидроксидов, от рН не зависят;
; см. раздел 10.3); в то же время потенциалы металлов в области, где не происходит выпадения их нерастворимых гидроксидов, от рН не зависят;
· поляризация процесса восстановления водорода больше поляризации разряда ионов металлов этой группы (или по-другому, выделение водорода на катоде происходит с более высоким перенапряжением по сравнению с перенапряжением разряда многих ионов металлов этой группы); пример: поляризационные кривые катодного выделения водорода и цинка (рис. 10.4).
Как видно из данного рисунка, равновесный потенциал цинкового электрода меньше потенциала водородного электрода, при малых плотностях тока на катоде выделяется лишь водород. Но водородное перенапряжение электрода больше, чем перенапряжение цинкового электрода, поэтому при повышении плотности тока начинает выделяться на электроде и цинк. При потенциале φ1 плотности токов выделения водорода и цинка одинаковы, а при потенциале φ2 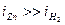 , т.е. на электроде выделяется в основном цинк.
, т.е. на электроде выделяется в основном цинк.
2. 
Анодные процессы.
2.1. На аноде в первую очередь идут процессы, характеризуемые наименьшим электродным потенциалом, т.е. в первую очередь окисляются сильные восстановители.
2.2. Обычно аноды подразделяют на инертные (нерастворимые) и активные (растворимые). Первые изготовляют из угля, графита, титана, платиновых металлов, имеющих значительный положительный электродный потенциал или покрытых устойчивой защитной плёнкой, служащих только проводниками электронов. Вторые – из металлов, ионы которых присутствуют в растворе электролита – из меди, цинка, серебра, никеля и др.
2.3. На инертном аноде при электролизе водных растворов щелочей, кислородосодержащих кислот и их солей, а также НF и ее солей (фторидов) происходит электрохимическое окисление гидроксид-ионов с выделением кислорода. В зависимости от рН раствора этот процесс протекает по- разному и может быть записан различными уравнениями:
а) в кислой и нейтральной среде
2 Н2О – 4еˉ = О2 + 4 Н+;
б) в щелочной среде
4ОН  – 4еˉ = О2 + 2Н2О.
– 4еˉ = О2 + 2Н2О.
Потенциал окисления гидроксид-ионов (потенциал кислородного электрода) рассчитывается по уравнению (см. раздел 10.3):
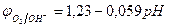 .
.
Кислородосодержащие анионы SO  , SO
, SO 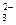 , NO
, NO 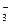 , CO
, CO 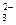 , PO
, PO 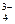 и т.д. или не способны окисляться, или их окисление происходит при очень высоких потенциалах, например: 2SO
и т.д. или не способны окисляться, или их окисление происходит при очень высоких потенциалах, например: 2SO  - 2eˉ = S2O
- 2eˉ = S2O 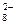
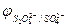 = 2,01 В.
= 2,01 В.
2.4. При электролизе водных растворов бескислородных кислот и их солей (кроме НF и ее солей) у инертного анода разряжаются их анионы.
Отметим, что выделение хлора (Cl2) при электролизе раствора НCl и её солей, выделение брома (Br2) при электролизе раствора HBr и её солей противоречит взаимному положению систем.
2Cl  - 2eˉ = Cl2
- 2eˉ = Cl2 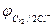 = 1,356 В
= 1,356 В
2Br  - 2eˉ = Br2
- 2eˉ = Br2 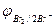 = 1,087 В
= 1,087 В
2H2O - 4eˉ = O2 + 4 Н+ 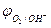 = 0,82 В (рН = 7)
= 0,82 В (рН = 7)
 Эта аномалия связана с анодной поляризацией процессов (рис. 10.5). Как видно, равновесный потенциал кислородного электрода (потенциал окисления гидроксид-ионов из воды) меньше равновесного потенциала хлорного электрода (потенциала окисления хлорид-ионов). Поэтому при малых плотностях тока выделяется лишь кислород. Однако выделение кислорода протекает с более высокой поляризацией, чем выделение хлора, поэтому при потенциале
Эта аномалия связана с анодной поляризацией процессов (рис. 10.5). Как видно, равновесный потенциал кислородного электрода (потенциал окисления гидроксид-ионов из воды) меньше равновесного потенциала хлорного электрода (потенциала окисления хлорид-ионов). Поэтому при малых плотностях тока выделяется лишь кислород. Однако выделение кислорода протекает с более высокой поляризацией, чем выделение хлора, поэтому при потенциале 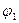 токи на выделение хлора и кислорода сравниваются, а при потенциале
токи на выделение хлора и кислорода сравниваются, а при потенциале 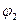 (высокая плотность тока) выделяется в основном хлор.
(высокая плотность тока) выделяется в основном хлор.
Если потенциал металлического анода меньше, чем потенциал ионов ОН  или других веществ, присутствующих в растворе или на электроде, то протекает электролиз с активным анодом. Активный анод окисляется, растворяясь: Ме – neˉ ® Men+.
или других веществ, присутствующих в растворе или на электроде, то протекает электролиз с активным анодом. Активный анод окисляется, растворяясь: Ме – neˉ ® Men+.
Выход по току. Если потенциалы двух или нескольких электродных реакций равны, то эти реакции протекают на электроде одновременно. При этом прошедшее через электрод электричество расходуется на все эти реакции. Доля количества электричества, расходуемая на превращение одного из веществ (Bj), называется выходом по току этого вещества:
(Bj) % = (Qj/Q) . 100,
где Qj – количество электричества, израсходованное на превращение j-го вещества; Q – общее количество электричества, прошедшее через электрод.
Например, из рис. 10.4 следует, что выход по току цинка растет с увеличением катодной поляризации. Для данного примера высокое водородное перенапряжение – явление положительное. Вследствие этого из водных растворов удается выделять на катоде марганец, цинк, хром, железо, кобальт, никель и другие металлы.
Закон Фарадея. Теоретическое соотношение между количеством прошедшего электричества и количеством вещества, окисленного или восстановленного на электроде, определяется законом Фарадея, согласно которому масса электролита, подвергшаяся химическому превращению, а также масса веществ, выделившихся на электродах, прямо пропорциональны количеству прошедшего через электролит электричества и молярным массам эквивалентов веществ: m = MэIt/F,
где m – масса электролита, подвергшаяся химическому превращению,
или масса веществ – продуктов электролиза, выделившихся на электродах, г; Mэ – молярная масса эквивалента вещества, г/моль; I – сила тока, А; t – продолжительность электролиза, с; F – число Фарадея – 96480 Кл/моль.
Пример 1. Как протекает электролиз водного раствора сульфата натрия с угольным (инертным) анодом?
Решение.
Na2SO4 = 2Na+ + SO 
H2O D H+ + OH 
| (-) K | A (+) | |
| Na+, H2O (H+) | SO42-, H2O (OH  ) )
| |
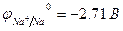
| 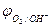 = 0,82B = 0,82B
| |
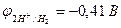
| 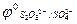 = 2,01B = 2,01B
| |
2| 2H2O + 2eˉ= H2 + 2OH 
| 2H2O – 4eˉ = O2 + 4H+ |
Суммарное уравнение:
6Н2О = 2Н2 + О2 + 4ОН  + 4Н+
+ 4Н+
или в молекулярной форме
6Н2О + 2Na2SO4 = 2Н2 + О2 + 4NaОН + 2Н2SO4.
В прикатодном пространстве накапливаются ионы Na+ и ионы ОН-, т.е. образуется щелочь, а около анода среда становится кислой за счёт образования серной кислоты. Если катодное и анодное пространство не разделены перегородкой, то ионы Н+ и ОН  образуют воду, и уравнение примет вид
образуют воду, и уравнение примет вид
2Н2О = 2Н2 + О2.
Итак, электролиз водного раствора сульфата натрия сводится к электролизу воды, а растворённая соль остаётся неизменной.
Пример 2. Как протекает электролиз водного раствора хлорида меди (II) CuCl2 с угольным анодом?
Решение.
CuCl2 = Cu2+ + 2Cl 
H2O D H+ + OH  .
.
| (-) K | А (+) | |
| Cu2+, H2O (H+) | Cl  , H2O (ОH , H2O (ОH  ) )
| |
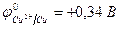
| 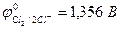
| |
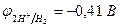
| 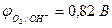
| |
| из-за анодной поляризации при высоких i протекает процесс: | ||
| Cu2+ + 2e– = Сu | 2Cl  - 2e– = Сl2 - 2e– = Сl2
|
Суммарное уравнение:
Cu2+ + 2Cl  = Cu + Cl2
= Cu + Cl2
или в молекулярной форме: CuCl2 = Cu + Cl2.
Пример 3. Как протекает процесс электролиза раствора сульфата цинка с инертным анодом?
Решение.
ZnSO4 = Zn2+ + SO 
H2O D H+ + OH 
| (-) K | (+) A | |
| Zn2+, H2O (H+) | SO42-, H2O (OH-) | |
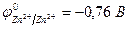
| 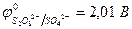
| |
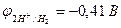
| 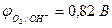
| |
| Из-за катодной поляризации протекают два процесса: | ||
| Zn2+ + 2e– = Zn | 2Н2О - 4е– = О2 + 4Н+ | |
2Н2О +2е– = Н2 + 2ОН 
|
Суммарное уравнение реакции:
Zn2+ + 2H2O = Zn + H2 + O2 + 2H+
или в молекулярном виде
ZnSO4 + 2H2O = Zn + H2 + O2 + H2SO4
Пример 4. Как протекает электролиз водного раствора сульфата меди (II) с активным анодом?
Решение.
CuSO4 = Cu2+ + SO 
H2O D H+ + OH 
| (-) K | А (Cu) (+) | |
| Cu2+, H2O (H+) | SO  , H2O (ОH , H2O (ОH  ) )
| |
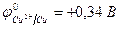
| 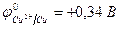
| |
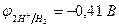
| 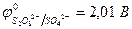
| |
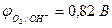
| ||
| Сu2+ + 2e– = Сu | Cu - 2e– = Сu2+ |
Суммарное уравнение:
Cu2+ + Cu = Cu + Cu2+
или в молекулярном виде
CuSO4 + Cu = Cu + CuSO4.
Концентрация CuSO4 в растворе при этом останется постоянной. Этот процесс применяется для электролитической очистки меди (электролитическое рафинирование).
Пример 5. Как протекает электролиз водного раствора хлорида цинка с активным анодом?
Решение.
ZnCl2 = Zn2+ + 2Cl 
H2O D H+ + OH-
| (-) K | A (Zn) (+) | |
| Zn2+, H2O(H+) | Cl  , H2O (OH , H2O (OH  ) )
| |
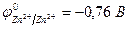
| 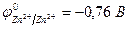
| |
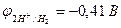
| 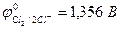
| |
| Из-за катодной поляризации | 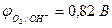
| |
| будут протекать два процесса: | ||
| Zn2+ + 2e– = Zn | Zn – 2e– = Zn2+ | 2 | |
2Н2О +2е– =Н2+ 2ОН 
|
Суммарное уравнение:
Zn + 2H2O = H2 + Zn2+ + 2OH-
или в молекулярной форме
Zn + 2H2O = H2 + Zn(OH)2 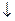 .
.
Пример 6. Определите массу цинка, которая выделится на катоде при электролизе раствора сульфата цинка в течение 1 часа при токе 26,8А, если выход цинка по току равен 50%.
Решение. В соответствии с законом Фарадея определим массу цинка, который выделился бы, если бы на катоде протекал один процесс:
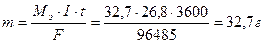
Выход цинка по току равен
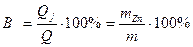
Отсюда масса выделившегося цинка составляет:
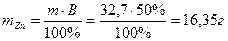
Применение электролиза.Практически нет ни одной отрасли техники, где бы он не применялся. В энергетике водород, полученный электролизом, используют для охлаждения генераторов на тепловых и атомных ЭС. Электролизом солей получают различные металлы: Cu, Zn, Cd, Ni, Mn и др. металлы. Электролиз используется для нанесения металлических покрытий на металлы и пластмассы (гальванические покрытия). Электролизом воды получают O2, H2, Cl2 и щёлочи из раствора хлорида натрия. Электролиз используют для зарядки аккумуляторов (см. раздел 10.2).
| <== предыдущая страница | | | следующая страница ==> |
| Гальванические элементы (химические источники электрического тока) | | | Коррозия металлов |
Дата добавления: 2014-09-29; просмотров: 1518; Нарушение авторских прав

Мы поможем в написании ваших работ!