
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ЭЛЕКТРОЛИЗ. 15.1.Электролизом называется совокупность окислительно-восстановительных процессов, которые протекают при пропускании постоянного электрического тока через
|
Читайте также: |
15.1.Электролизом называется совокупность окислительно-восстановительных процессов, которые протекают при пропускании постоянного электрического тока через раствор или расплав электролита. Под влиянием электрического тока движение ионов становится направленным: отрицательные анионы перемещаются к положительно поляризованному аноду, а положительные катионы - к катоду, который соединён с отрицательным полюсом источника питания.
На катоде идёт процесс восстановления, а на аноде - окисления.
При электролизе катод служит восстановителем (отдает электроны катионам), а анод – окислителем (принимает электроны от анионов). Сущность электролиза состоит в осуществлении за счет электрической энергии химических реакций – восстановления на катоде (К) и окисления на аноде (А). Эти процессы называются процессами (реакциями) электровосстановления и электроокисления. Восстановительное и окислительное действие электрического тока во много раз сильнее действия химических окислителей и восстановителей.
15.2.Различают электролиз расплавов и растворов электролитов.
Электролиз расплавов солей
Катодные процессы.
1) Все катионы металлов восстанавливаются на катоде:
К(-): Zn2+ + 2e- → Zn0; Na+ + 1e- → Na0
Анодные процессы.
1) Анионы бескислородных кислот окисляются на аноде:
А(+): 2Cl¯ - 2e-→Cl2
2) Анионы кислородсодержащих кислот образуют соответствующий кислотный оксид и кислород:
А(+): 2SO42ˉ - 4e- → 2SO3 + O2
Электролиз водных растворов электролитов
Катодные процессы.
При прочих равных условиях ионы металлов восстанавливаются на катоде тем легче, чем менее активен металл, чем дальше вправо он расположен в ряду напряжений.
1) Катионы металлов, имеющие электродный потенциал более высокий, чем у ионов водорода Н+ (в ряду напряжений эти металлы стоят после Н2), при электролизе практически полностью восстанавливаются на катоде:
Cu2+ + 2e- → Cu0
2) Катионы металлов, имеющие низкую величину электродного потенциала (от начала ряда напряжения по алюминий включительно), не восстанавливаются на катоде и остаются в растворе, на катоде идет процесс электрохимического восстановления водорода из молекул воды:
2H2O + 2e- → H2 + 2OH¯
3) Катионы металлов, имеющие электродный потенциал ниже , чем у ионов водорода (Н+), но выше, чем у ионов алюминия (Al3+), т.е стоящих между Zn2+→ Men+ ← H2, при электролизе восстанавливаются на катоде одновременно с водородом.
Fe3+ + 3e- → Fe0
2H2O + 2e- → H2 + 2OH¯
Анодные процессы.
При электролизе веществ используется инертные, не изменяющиеся в процессе электролиза аноды (графитовые, платиновые) и растворимые аноды, окисляющиеся в процессе электролиза легче, чем анионы (из цинка, никеля, серебра, меди и других металлов).
1) Анионы бескислородных кислот (S2ˉ, I¯, Br¯, Cl¯) при их достаточной концентрации легко окисляются до соответствующих простых веществ.
2) При электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, а также плавиковой кислоты и фторидов происходит электрохимическое окисление воды с выделение кислорода:
в щелочных растворах: 4OH¯ - 4e- → O2 + 2H2O
в кислых и нейтральных растворах: 2H2O - 4e- → O2 + 4H+
15.3. Количественно процессы электролиза оцениваются законами Фарадея: масса электролита, подвергшаяся превращению при электролизе, а также массы образующихся на электродах веществ прямо пропорциональны количеству электричества, прошедшего через раствор или расплав электролита, и эквивалентным массам соответствующих веществ.
Закон выражается уравнением
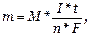 или
или 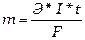 , (6)
, (6)
где m - масса образовавшегося или подвергшегося превращению вещества;
М - мольная масса этого вещества;
n - число молей электронов, участвующих в процессе образования 1 моля вещества;
I - сила тока, А;
t - время электролиза, с;
F - постоянная Фарадея, (96500 Kл/моль);
Э - эквивалентная масса вещества;
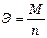 . (7)
. (7)
Для вычисления объема выделяющегося газа (V) уравнение имеет вид:
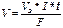 , (8)
, (8)
где Vэ = 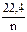 ; Vэ - эквивалентный объем газа.
; Vэ - эквивалентный объем газа.
При нормальных условиях эквивалентный объем водорода равен 11,2 л/моль, а кислорода 5,6 л/моль.
Выходом по току называют ту долю от общего количества электричества (Q = I*t), которая расходуется на данную электродную реакцию или отношение массы выделившегося вещества mпракт к теоретически возможной mтеор по уравнению Фарадея
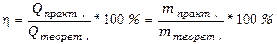 . (9)
. (9)
| <== предыдущая страница | | | следующая страница ==> |
| ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ И ЭЛЕКТРОДВИЖУЩИЕ СИЛЫ | | |
Дата добавления: 2014-09-08; просмотров: 471; Нарушение авторских прав

Мы поможем в написании ваших работ!