
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Электродные потенциалы. Электродвижущие силы. Электролиз
Электродные потенциалы. Электродвижущие силы
Электродные потенциалы и механизм их возникновения.
Водородный электрод. Стандартные электродные потенциалы металлов. Ряд стандартных электродных потенциалов.
Принцип действия и электродвижущие силы гальванического элемента.
Электродные потенциалы. Электродвижущие силы. Электролиз
Электролиз
Электролиз с нерастворимыми и растворимыми электродами.
Законы Фарадея.
Тема 1. Строение веществ. Систематика химических элементов
Рассматриваемые вопросы:
1. Основные химические понятия и законы.
2. Строение атома.
3. Периодическая система химических элементов Д.И. Менделеева.
4. Ориентировочная оценка пожароопасных свойств простых и сложных веществ в зависимости от положения химических элементов в периодической системе.
Химия – наука, изучающая свойства и превращения веществ, сопровождающиеся изменением их состава и строения.
Вещество – это конкретный вид материи, обладающий определенными физическими и химическими свойствами, состав которого может быть выражен химической формулой.
Химической реакцией называется процесс превращения одних веществ в другие.
Способность вещества участвовать в тех или иных химических реакциях характеризует его химические свойства.
Простое вещество состоит из атомов одного и того же химического элемента.
Химические соединения состоят из атомов нескольких элементов.
Атомно – молекулярное учение
Атомы – мельчайшие химические частицы, являющиеся пределом химического разложения любого вещества.
Химический элемент представляет собой вид атомов с одинаковым положительным зарядом ядра.
Другими словами, атом – это наименьшая частица химического элемента, сохраняющая все его химические свойства.
В настоящее время известно 117 химических элементов, из которых 92 встречаются в природе.
Абсолютное большинство различных веществ состоит из молекул.
Молекула – наименьшая частица вещества, способная существовать самостоятельно и сохраняющая его основные химические свойства.
Массы атомов химических элементов чрезвычайно малы: ~ 10-27 – 10-25 кг. В химии пользуются относительными значениями масс атомов (Ar, где r – «относительный», от англ. relative).
Относительная атомная масса – это масса атома, выраженная в атомных единицах массы. За атомную единицу массы принята 1/12 часть массы атома нуклида 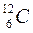 :
:
1 а.е.м. = 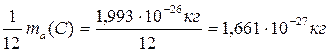 .
.
Относительная атомная масса – величина безразмерная.
Соответственно, относительная молекулярная масса Mr вещества – это масса его молекулы, выраженная в а.е.м.
Единицей измерения количества вещества (n) является моль.
Моль – количество вещества, содержащее столько структурных элементарных единиц (атомов, молекул, ионов, электронов и т.д.), сколько содержится атомов в 0,012 кг изотопа углерода 12С.
Число атомов NA в 0,012 кг углерода, или в 1 моль, легко определить следующим образом:
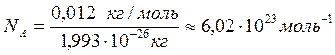 .
.
Величина NA называется постоянной Авогадро.
| <== предыдущая страница | | | следующая страница ==> |
| Энергетика химических процессов | | | Основные стехиометрические законы химии |
Дата добавления: 2014-04-24; просмотров: 394; Нарушение авторских прав

Мы поможем в написании ваших работ!