
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ЛЕКЦИЯ 5 ЭЛЕКТРОДНЫЕ ПРОЦЕССЫ. ПОЛЯРИЗАЦИЯ
Защита металлов от коррозии: легирование металлов, защитные покрытия, электрохимическая защита (протекторная), изменение свойств коррозионной среды, защита от коррозии блуждающими токами.
Коррозию металлов можно затормозить изменением потенциала металла, пассивированием металла, снижением концентрации окислителя, изоляцией поверхности металла от окислителя, изменением состава металла и др. Выбор способа определяется его эффективностью, а также экономической целесообразностью. Все методы защиты условно делятся на следующие группы: а) легирование металлов; б) защитные покрытия (металлические, неметаллические); в) электрохимическая защита; г) изменение свойств коррозионной среды; д) рациональное конструирование изделий.
Легирование металлов - эффективный (хотя и дорогой) метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивацию металла. В качестве таких компонентов применяют хром, никель, вольфрам и др. К коррозионностойким сплавам, например, относятся нержавеющие стали, в которых легирующим компонентом служат хром, никель, и другие металлы. содержание хром, кремний, молибдена (4-9%) улучшает жаропрочность стали, такие сплавы применяют в парогенераторо- турбостроении. Сплав, содержащий 9-12% хрома, применяет для изготовления турбин, деталей реактивных двигателей и т.п.
Защитные покрытия. Слои, искусственно создаваемые на поверхности металлических изделий и сооружений для предохранения их от коррозии, называются защитными покрытиями. Если наряду с защитой от коррозии покрытие служит также для декоративных целей, его называют защитно-декоративным. Выбор вида покрытия зависит от условий, в которых используется металл.
а) металлические покрытия. Материалами для металлических защитных покрытий могут быть как чистые металлы (цинк, кадмий, алюминий, никель, медь, хром, серебро и др.), так и их сплавы (бронза, латунь и др. По характеру поведения металлических покрытий при коррозии их можно разделить на катодные и анодные.
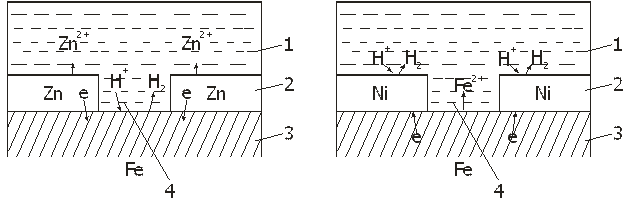
Ккатоднымпокрытиям относятся покрытия, потенциалы которых в данной среде имеют более положительное значение, чем потенциал основного металла. В качестве примеров катодных покрытий на стали можно привести Си, Ni, Ag. При повреждении покрытия (или наличии пор) возникает коррозионный элемент, в котором основной материал в поре служит анодом и растворяется, а материал покрытия — катодом, на котором выделяется водород или поглощается кислород (Рис. 1а). Следовательно, катодные покрытия могут защищать металл от коррозии лишь при отсутствии пор и повреждений покрытия.
анодныепокрытияимеют более отрицательный потенциал, чем потенциал основного металла. Примером анодного покрытия может служить цинк на стали. (Рис. 1б). В этом случае основной металл будет катодом коррозионного элемента, поэтому он не корродирует. Потенциалы металлов зависят от состава растворов, поэтому при изменении состава раствора может меняться и характер покрытия. Так, покрытие стали оловом в растворе H2SO4 - катодное, а в растворе органических кислот - анодное.
|
|
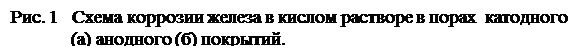
|
Для получения металлических защитных покрытий применяются различные способы:
- электрохимический (гальванические покрытия), погружение в расплавленный металл, металлизация, термодиффузионный и химический. Из расплава получают покрытие цинка (горячеецинкование) и олова (горячее лужение).
- химический способ получения металлических покрытий заключается в восстановлении соединений металла с помощью водорода, гидразина и других восстановителей.
в) К органическим покрытиям относятся лакокрасочные покрытия, покрытия смолами, пластмассами, полимерными пленками, резиной.
Лакокрасочные покрытия наиболее распространены и незаменимы. Лакокрасочное покрытие должно быть сплошным, беспористым, газо- и водонепроницаемым, химически стойким, эластичным, обладать высоким сцеплением с материалом, механической прочностью и твердостью.
г) В качестве неорганических покрытий применяют неорганические эмали, оксиды металлов, соединения хрома, фосфора и др.
- Образование на поверхности металлических изделий защитных оксидных пленок в технике называют оксидированием. Так, например, процессы нанесения на сталь оксидных пленок иногда называют воронением, а электрохимическое оксидирование алюминия — анодированием.
- Фосфатные покрытия на стали получают из растворов ортофосфорной кислоты и ортофосфатов марганца или цинка (например, ZnHPO4 + H3PO4). При реакции образуется пористый кристаллический фосфат металла, хорошо сцепленный с поверхностью стали. Сами по себе фосфатные покрытия не обеспечивают достаточной защиты от коррозии. Их используют в основном в качестве подложки под краску, что повышает сцепление лакокрасочного покрытия со сталью и уменьшает коррозию в местах царапин.
Электрохимическая защита (протекторная) осуществляется присоединением к защищаемой конструкции металла с более отрицательным значением электродного потенциала. Такие металлы называются протекторами.Вспомогательный электрод (анод) растворяется, на защищаемом сооружении (катоде) выделяется водород.Для их изготовления большей частью используют магний и его сплавы, цинк, алюминий.
Наиболее применима электрохимическая защита в коррозионных средах с хорошей ионной электрической проводимостью. Сущность катодной защиты заключается в том, что защищаемое изделие подключается к отрицательному полюсу внешнего источника постоянного тока, поэтому оно становится катодом, а анодом служит вспомогательный, обычно стальной электрод. Катодная поляризация используется для защиты от коррозии подземных трубопроводов, кабелей. Катодную защиту применяют также к шлюзовым воротам, подводным лодкам, водным резервуарам, морским трубопроводам и оборудованию химических заводов.
Изменение свойств коррозионной среды.Для снижения агрессивности среды уменьшают концентрацию компонентов, опасных в коррозионном отношении. Например, в нейтральных средах коррозия обычно протекает с поглощением кислорода. Его удаляют деаэрацией (кипячение, барботаж инертного газа) или восстанавливают с помощью соответствующих восстановителей (сульфиты, гидразин и т. п.). Агрессивность среды может уменьшаться также при снижении концентрации ионов Н+, т. е. повышении рН (подщелачивании). Для защиты от коррозии широко применяют ингибиторы.
Ингибитором называется вещество, при добавлении которого в среду, где находится металл, значительно уменьшается скорость коррозии металла. К анодным замедлителям нужно отнести замедлители окисляющего действия, например нитрит натрия NaNО2, дихромат натрия Na2Cr2O7. К катодным ингибиторам относятся органические вещества, содержащие азот, серу и кислород, например диэтиламин, уротропин, формальдегид, тиокрезол.
Защита от коррозии блуждающими токами.Токи, ответвляющиеся от своего основного пути, называются блуждающими. Источниками блуждающих токов могут быть различные системы и устройства, работающие на постоянном токе, например железнодорожные пути электропоездов, заземления постоянного тока, установки для электросварки, электролизные ванны, системы катодной защиты и т. д.
Коррозия металлов под влиянием электрического тока от внешнего источника называется электрокоррозией. В качестве примера рассмотрим электрокоррозию подземного трубопровода во влажной почве. Схема возникновения блуждающего тока от трамвайной линии, где стальные рельсы используются для возвращения тока к генераторной станции. Борьба с коррозией блуждающими токами заключается, прежде всего, в их уменьшении. Для электрифицированных железных дорог, у которых рельсы служат обратными проводами, это достигается поддержанием в хорошем состоянии электрических контактов между рельсами и увеличением сопротивления между рельсами и почвой.
ЛЕКЦИЯ 5 ЭЛЕКТРОДНЫЕ ПРОЦЕССЫ. ПОЛЯРИЗАЦИЯ
Изменение потенциала электрода при прохождении тока называется поляризацией:
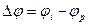 ,
,
где  - поляризация;
- поляризация; 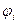 - потенциал электрода при прохождении тока;
- потенциал электрода при прохождении тока; 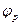 - равновесный потенциал.
- равновесный потенциал.
Термин «поляризация» обозначает и само физическое явление, и величину поляризации. Различают катодную 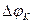 и анодную
и анодную 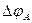 поляризации. Для исследования поляризации строят экспериментальную кривую зависимости потенциала электрода от силы протекающего через электрод тока.
поляризации. Для исследования поляризации строят экспериментальную кривую зависимости потенциала электрода от силы протекающего через электрод тока.
Чтобы понять сущность измерения поляризации рассмотрим элемент Даниэля-Якоби с включенным во внешнюю цепь переменным сопротивлением R, вольтметром V, амперметром А (рис.1).
Рис.1 Поляризующийся медно-цинковый элемент
Разность потенциалов между цинковым и медным электродами в отсутствии тока близка к 1 В. Если, изменяя внешнее сопротивление, добиться протекания тока во внешней цепи, то напряжение элемента становится меньше 1 В вследствие поляризации обоих электродов. Чем больше ток во внешней цепи, тем меньше напряжение; при коротком замыкании напряжение между медным и цинковым электродами приближается к нулю. Влияние силы тока на напряжение элемента Даниэля- Якоби можно графически изобразить в виде поляризационной диаграммы (рис.2), которая представляет собой зависимость потенциалов 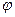 медного и цинкового электродов от полного тока I . Символы
медного и цинкового электродов от полного тока I . Символы 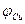 и
и 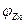 отвечают разомкнутому элементу.
отвечают разомкнутому элементу.
Рис.2. Поляризационная диаграмма медно-цинкового элемента
Поляризации цинкового электрода соответствует линия abc, поляризации медного электрода линия def . При силе тока, равной 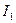 , поляризация цинка равна
, поляризация цинка равна 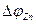 , а меди -
, а меди - 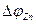 . Разность потенциалов поляризованных электродов равна силе тока
. Разность потенциалов поляризованных электродов равна силе тока 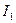 , умноженной на общее сопротивление, которое складывается из сопротивления металлов
, умноженной на общее сопротивление, которое складывается из сопротивления металлов 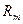 , сопротивления электролита
, сопротивления электролита 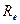 :
:
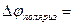
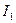 (
( 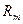 +
+ 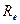 ).
).
При короткозамкнутом элементе ток максимален, а сопротивлением металлов можно пренебречь, в этом случае разность потенциалов снижается до минимума и равна:
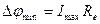 .
.
Различают три вида поляризаций: концентрационная поляризация, активационная поляризация и омическое падение напряжения.
Концентрационная поляризация – изменение потенциала электрода вследствие изменения концентрации реагентов в приэлектродном слое при прохождении тока.
Рассмотрим медный электрод в элементе Даниэля-Якоби.
В отсутствие внешнего тока потенциал меди 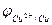 (1) можно определить по формуле Нернста:
(1) можно определить по формуле Нернста:
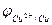 (1) =0,34+
(1) =0,34+ 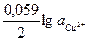 ,
,
где 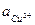 - активность ионов меди.
- активность ионов меди.
Если в элементе течет ток, то медь осаждается на электроде, при этом концентрация около поверхности, а следовательно, активность ионов меди снижается до ( 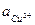 )
) 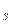 тогда потенциал медного электрода равен:
тогда потенциал медного электрода равен:
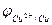 (2) =0,34+
(2) =0,34+ 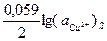 .
.
Вследствие того, что ( 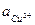 )
) 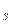
 , потенциал поляризованного катода более отрицателен. Разность потенциалов
, потенциал поляризованного катода более отрицателен. Разность потенциалов 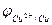 (2) и
(2) и 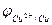 (1) и есть концентрационная поляризация:
(1) и есть концентрационная поляризация:
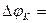
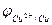 (2) –(1)
(2) –(1) 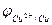 = -
= - 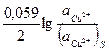
Чем больше ток, протекающий в системе, тем меньше концентрация ионов меди около электрода ( 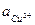 )
) 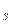 , а значит, больше концентрационная поляризация. Плотность тока, при которой (
, а значит, больше концентрационная поляризация. Плотность тока, при которой ( 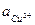 )
) 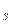 приближается к нулю называется предельной плотностью тока.
приближается к нулю называется предельной плотностью тока.
Концентрационная поляризация связана с предельной плотностью тока выражением:
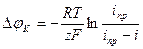
где 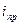 - предельная плотность тока для катодной реакции, A/
- предельная плотность тока для катодной реакции, A/  ;
; 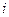 - плотность внешнего тока, A/
- плотность внешнего тока, A/  .
.
Активационная поляризация 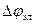 обусловлена замедленность электродной реакции, потребностью в дополнительной энергии для протекания электродной реакции. Примером может служить восстановлении ионов водорода на катоде:
обусловлена замедленность электродной реакции, потребностью в дополнительной энергии для протекания электродной реакции. Примером может служить восстановлении ионов водорода на катоде:
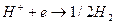
Активационная поляризация этого процесса называется водородным перенапряжением.
На платиновом катоде процесс восстановления водорода идет в такой последовательности: в начале идет относительно быстрая реакция:
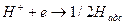
где 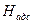 - атомы водорода, адсорбированного на поверхности металла.
- атомы водорода, адсорбированного на поверхности металла.
Затем из атомов водорода образуются молекулы 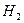 и пузырьки газообразного водорода:
и пузырьки газообразного водорода:

.
Эта реакция протекает достаточно медленно и ее скорость, как скорость самой медленной стадии, определяет значение водородного перенапряжения на платине.
Активационная поляризация 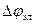 любого типа возрастает с увеличением плотности тока
любого типа возрастает с увеличением плотности тока 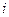 согласно уравнению Тафеля:
согласно уравнению Тафеля:

где 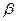 и
и 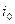 - константы для данного металла и среды электролита, зависящие от температуры. Знак «+» относится к анодному перенапряжению, знак «-» - к катодному перенапряжению.
- константы для данного металла и среды электролита, зависящие от температуры. Знак «+» относится к анодному перенапряжению, знак «-» - к катодному перенапряжению.
В таблице даны значения водородного перенапряжения для различных металлов при разных условиях.
Таблица 1
Значения водородного перенапряжения на различных
металлах при 20 С
| Металл | Раствор электролита | 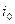 , A/ , A/ 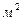
| 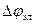 ,В ,В
|
| Pt | 1 н. HCl | 0,00 | |
| Ni | 0,1 н. HCl | 8 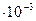
| 0,31 |
| Sn | 1 н. HCl | 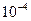
| 0,72 |
| Hg | 1 н. HCl | 7 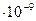
| 1,1 |
Водородное перенапряжение уменьшается с повышением температуры, с увеличением шероховатости поверхности и уменьшением плотности тока.
Омическое падение напряжения в слое электролита, окружающего электрод:
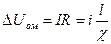
где 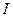 - сила тока, А; R - сопротивление слоя электролита, Ом;
- сила тока, А; R - сопротивление слоя электролита, Ом; 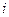
- плотность тока, A/  ; l- длина слоя электролита, см;
; l- длина слоя электролита, см; 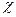 - удельная электрическая проводимость электролита, Cм/см.
- удельная электрическая проводимость электролита, Cм/см.
Поляризация, связанная с омическим падением напряжения, исчезает одновременно с выключением тока.
| <== предыдущая страница | | | следующая страница ==> |
| ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ. Защита металлов от коррозии: легирование металлов, защитные покрытия, электрохимическая защита (протекторная) | | | Лекция №6 Социальная политика в условиях запаздывающей модернизации |
Дата добавления: 2014-05-04; просмотров: 710; Нарушение авторских прав

Мы поможем в написании ваших работ!