
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ. Защита металлов от коррозии: легирование металлов, защитные покрытия, электрохимическая защита (протекторная)
Защита металлов от коррозии: легирование металлов, защитные покрытия, электрохимическая защита (протекторная), изменение свойств коррозионной среды, защита от коррозии блуждающими токами.
Коррозию металлов можно затормозить изменением потенциала металла, пассивированием металла, снижением концентрации окислителя, изоляцией поверхности металла от окислителя, изменением состава металла и др. Выбор способа определяется его эффективностью, а также экономической целесообразностью. Все методы защиты условно делятся на следующие группы: а) легирование металлов; б) защитные покрытия (металлические, неметаллические); в) электрохимическая защита; г) изменение свойств коррозионной среды; д) рациональное конструирование изделий.
Легирование металлов - эффективный (хотя и дорогой) метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивацию металла. В качестве таких компонентов применяют хром, никель, вольфрам и др. К коррозионностойким сплавам, например, относятся нержавеющие стали, в которых легирующим компонентом служат хром, никель, и другие металлы. содержание хром, кремний, молибдена (4-9%) улучшает жаропрочность стали, такие сплавы применяют в парогенераторо- турбостроении. Сплав, содержащий 9-12% хрома, применяет для изготовления турбин, деталей реактивных двигателей и т.п.
Защитные покрытия. Слои, искусственно создаваемые на поверхности металлических изделий и сооружений для предохранения их от коррозии, называются защитными покрытиями. Если наряду с защитой от коррозии покрытие служит также для декоративных целей, его называют защитно-декоративным. Выбор вида покрытия зависит от условий, в которых используется металл.
а) металлические покрытия. Материалами для металлических защитных покрытий могут быть как чистые металлы (цинк, кадмий, алюминий, никель, медь, хром, серебро и др.), так и их сплавы (бронза, латунь и др. По характеру поведения металлических покрытий при коррозии их можно разделить на катодные и анодные.
Ккатоднымпокрытиям относятся покрытия, потенциалы которых в данной среде имеют более положительное значение, чем потенциал основного металла. В качестве примеров катодных покрытий на стали можно привести Си, Ni, Ag. При повреждении покрытия (или наличии пор) возникает коррозионный элемент, в котором основной материал в поре служит анодом и растворяется, а материал покрытия — катодом, на котором выделяется водород или поглощается кислород (Рис. 1а). Следовательно, катодные покрытия могут защищать металл от коррозии лишь при отсутствии пор и повреждений покрытия.
анодныепокрытияимеют более отрицательный потенциал, чем потенциал основного металла. Примером анодного покрытия может служить цинк на стали. (Рис. 1б). В этом случае основной металл будет катодом коррозионного элемента, поэтому он не корродирует. Потенциалы металлов зависят от состава растворов, поэтому при изменении состава раствора может меняться и характер покрытия. Так, покрытие стали оловом в растворе H2SO4 - катодное, а в растворе органических кислот - анодное.
|
|
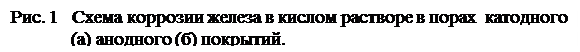
|
Для получения металлических защитных покрытий применяются различные способы:
- электрохимический (гальванические покрытия), погружение в расплавленный металл, металлизация, термодиффузионный и химический. Из расплава получают покрытие цинка (горячеецинкование) и олова (горячее лужение).
- химический способ получения металлических покрытий заключается в восстановлении соединений металла с помощью водорода, гидразина и других восстановителей.
в) К органическим покрытиям относятся лакокрасочные покрытия, покрытия смолами, пластмассами, полимерными пленками, резиной.
Лакокрасочные покрытия наиболее распространены и незаменимы. Лакокрасочное покрытие должно быть сплошным, беспористым, газо- и водонепроницаемым, химически стойким, эластичным, обладать высоким сцеплением с материалом, механической прочностью и твердостью.
г) В качестве неорганических покрытий применяют неорганические эмали, оксиды металлов, соединения хрома, фосфора и др.
- Образование на поверхности металлических изделий защитных оксидных пленок в технике называют оксидированием. Так, например, процессы нанесения на сталь оксидных пленок иногда называют воронением, а электрохимическое оксидирование алюминия — анодированием.
- Фосфатные покрытия на стали получают из растворов ортофосфорной кислоты и ортофосфатов марганца или цинка (например, ZnHPO4 + H3PO4). При реакции образуется пористый кристаллический фосфат металла, хорошо сцепленный с поверхностью стали. Сами по себе фосфатные покрытия не обеспечивают достаточной защиты от коррозии. Их используют в основном в качестве подложки под краску, что повышает сцепление лакокрасочного покрытия со сталью и уменьшает коррозию в местах царапин.
Электрохимическая защита (протекторная) осуществляется присоединением к защищаемой конструкции металла с более отрицательным значением электродного потенциала. Такие металлы называются протекторами.Вспомогательный электрод (анод) растворяется, на защищаемом сооружении (катоде) выделяется водород.Для их изготовления большей частью используют магний и его сплавы, цинк, алюминий.
Наиболее применима электрохимическая защита в коррозионных средах с хорошей ионной электрической проводимостью. Сущность катодной защиты заключается в том, что защищаемое изделие подключается к отрицательному полюсу внешнего источника постоянного тока, поэтому оно становится катодом, а анодом служит вспомогательный, обычно стальной электрод. Катодная поляризация используется для защиты от коррозии подземных трубопроводов, кабелей. Катодную защиту применяют также к шлюзовым воротам, подводным лодкам, водным резервуарам, морским трубопроводам и оборудованию химических заводов.
Изменение свойств коррозионной среды.Для снижения агрессивности среды уменьшают концентрацию компонентов, опасных в коррозионном отношении. Например, в нейтральных средах коррозия обычно протекает с поглощением кислорода. Его удаляют деаэрацией (кипячение, барботаж инертного газа) или восстанавливают с помощью соответствующих восстановителей (сульфиты, гидразин и т. п.). Агрессивность среды может уменьшаться также при снижении концентрации ионов Н+, т. е. повышении рН (подщелачивании). Для защиты от коррозии широко применяют ингибиторы.
Ингибитором называется вещество, при добавлении которого в среду, где находится металл, значительно уменьшается скорость коррозии металла. К анодным замедлителям нужно отнести замедлители окисляющего действия, например нитрит натрия NaNО2, дихромат натрия Na2Cr2O7. К катодным ингибиторам относятся органические вещества, содержащие азот, серу и кислород, например диэтиламин, уротропин, формальдегид, тиокрезол.
Защита от коррозии блуждающими токами.Токи, ответвляющиеся от своего основного пути, называются блуждающими. Источниками блуждающих токов могут быть различные системы и устройства, работающие на постоянном токе, например железнодорожные пути электропоездов, заземления постоянного тока, установки для электросварки, электролизные ванны, системы катодной защиты и т. д.
Коррозия металлов под влиянием электрического тока от внешнего источника называется электрокоррозией. В качестве примера рассмотрим электрокоррозию подземного трубопровода во влажной почве. Схема возникновения блуждающего тока от трамвайной линии, где стальные рельсы используются для возвращения тока к генераторной станции. Борьба с коррозией блуждающими токами заключается, прежде всего, в их уменьшении. Для электрифицированных железных дорог, у которых рельсы служат обратными проводами, это достигается поддержанием в хорошем состоянии электрических контактов между рельсами и увеличением сопротивления между рельсами и почвой.
| <== предыдущая страница | | | следующая страница ==> |
| Лекция 4 Коррозия металлов | | | ЛЕКЦИЯ 5 ЭЛЕКТРОДНЫЕ ПРОЦЕССЫ. ПОЛЯРИЗАЦИЯ |
Дата добавления: 2014-05-04; просмотров: 487; Нарушение авторских прав

Мы поможем в написании ваших работ!