
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Лекция 4 Коррозия металлов
Технологии учебного процесса представляют собой цепь процедур по воспроизводству учебных ситуаций, рассматриваемых в свою очередь как модели жизненных ситуаций, в которых учащемуся предстоит действовать самостоятельно.
Это вовсе не исключает возможности представления учебной ситуации как модели прошедших и настоящих жизненных ситуаций учащегося. В этом плане их отличает динамичная направленность.
Технология в этой сфере регулирует факторы включения социокультурных механизмов деятельности учащегося, его занятий, соответственно предполагает наличие:
- побудительных средств включения учащегося в проектируемую ситуацию, его заинтересованность;
- побудительно-ориентировочные средства возможных действий учащегося;
- определенный уровень адаптивности, готовности включиться в учебную ситуацию в адекватной форме занятия; наличие средств, позволяющих поддерживать последующую ассимиляцию культурно-ценностного содержания учебной ситуации;
- коммуникативные средства взаимодействия с преподавателем как основным коммуникатором социокультурных ценностей, с другими участниками учебного процесса с предметами инфраструктуры, внеучебными факторами, средствами продуктивного самовыражения в результатах; самостоятельного труда.
Цикличность — выражение стабильности системы, координации и синхронизации ее связей.
Слайд
Для учебного процесса как и для любой системы саморегуляции характерно наличие ритмов и циклов действия.
Цикличность — выражение стабильности системы, координации и синхронизации ее связей.
В регуляции целенаправленно управляемого типа каждый цикл включает по крайней мере три фазы (этапа действий):
- подготовительный (предварительная фаза действий);
- оперативный (фаза непосредственного действия);
- результирующий (фаза завершающего действия).
Технологические циклы и фазы отчетливо прослеживаются в учебном процессе, где каждому этапу цикла свойственны свои учебные технологии.
На предварительном этапе — проектирование учебных программ, методик, планов учебных занятий, средств, материалов к занятиям учащегося, подготовка инфраструктуры. Здесь же вводятся ориентация учащихся, предварительная диагностика их возможностей и интересов по выполнению заданий, консультации в выборе заданий и занятий, отработка индивидуального плана (как и группового, поточного) обучения. В новых технологиях обучения на этом этапе все большая роль будет отводиться консультированию, выбору учащимся своего плана занятий.
На оперативном этапе вводятся такие технологии, как урок, лекция, семинар, лабораторное занятие, практикум, учебная игра, экскурсия, курсовой и дипломный проект, самостоятельная работа по выполнению учебных заданий, кинолекция, компьютерный урок и пр.
На результирующем этапе — экзамен, контрольная работа, зачет, собеседование, коллоквиум, учебная практика, тестовая проверка (в том числе с использованием компьютерных средств), конференция и пр.
Диагностика технологий учебного процесса необходимо предполагает выявление показателей уровня организованности, управляемости, обеспеченности каждой фазы соответствующей инфраструктурой.
Лекция 4 Коррозия металлов
Основные виды коррозии. Классификация коррозионных процессов. Химическая коррозия. Электрохимическая коррозия.
Коррозия — это разрушение металлов в результате его физико-химического взаимодействия с окружающей средой. При этом металлы окисляются и образуются продукты коррозии, состав которых зависит от условий коррозии.
Коррозия — самопроизвольный процесс и соответственно протекает с уменьшением энергии Гиббса системы. Химическая энергия реакции коррозионного разрушения металлов выделяется в виде теплоты и рассеивается в окружающем пространстве.
Химическая коррозия, характерна для сред, не проводящих электрический ток. При химической коррозии происходит прямое гетерогенное взаимодействие металла с окислителем окружающей среды.
Химическая коррозия, характерна для сред, не проводящих электрический ток. При химической коррозии происходит прямое гетерогенное взаимодействие металла с окислителем окружающей среды. По условиям протекания коррозионного процесса различают: а) газовую коррозию—в газах и парах без конденсации влаги на поверхности металла, обычно при высоких температурах. Примером газовой коррозии может служить окисление металла кислородом воздуха при высоких температурах; б) коррозию в неэлектролитах — агрессивных органических жидкостях, таких, как сернистая нефть и др.
Рассмотрим химическую коррозию в газах (газовая коррозия), в частности коррозию в атмосфере кислорода. Уравнение реакции окисления металлов кислородом можно записать в общем виде
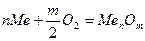
В соответствии с законами химической термодинамики эта реакция, как и другие реакции коррозии, может протекать лишь при условии уменьшения энергии Гиббса системы, т. е. при условии, если энергия Гиббса ниже нуля: 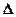 G<0. Так как, по определению, энергия Гиббса образования простых веществ равна нулю, то энергия Гиббса окисления металлов равна энергии Гиббса образования оксидов. Энергию Гиббса реакции окисления металлов рассчитывают по уравнению
G<0. Так как, по определению, энергия Гиббса образования простых веществ равна нулю, то энергия Гиббса окисления металлов равна энергии Гиббса образования оксидов. Энергию Гиббса реакции окисления металлов рассчитывают по уравнению
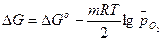 ,
,
где 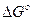 - стандартная энергия гиббса реакции;
- стандартная энергия гиббса реакции; 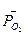 -относительное парциальное давление кислорода (р/100).
-относительное парциальное давление кислорода (р/100).
большинство металлов в атмосфере кислорода могут подвергаться химической коррозии. Однако термодинамика указывает лишь на возможность протекания процессов, но не может предсказать их скорость.
Электрохимическая коррозия характерна для сред, имеющих ионную проводимость. При электрохимической коррозии процесс взаимодействия металла с окислителем включает анодное растворение металла и катодное восстановление окислителя. Электрохимическая коррозия может протекать: а) в электролитах — в водных растворах солей, кислот, щелочей, в морской воде; б) в атмосфере любого влажного газа; в) в почве.
процессы электрохимической коррозии подобны процессам, протекающим в гальванических элементах. Основным отличием процессов электрохимической коррозии от процессов в гальваническом элементе является отсутствие внешней цепи. Электроны в процессе коррозии не выходят из корродирующего металла, а двигаются внутри металла. Химическая энергия реакции окисления металла передается не в виде работы, а лишь в виде теплоты. Окислители играют двойную роль в коррозионных процессах. С одной стороны, они могут восстанавливаться и этим ускорять коррозию металлов, а с другой (для металла, способного к пассивации) - вызвать пассивацию металла и резкое торможение коррозии. Обычно это наблюдается на металлах, способных пассивироваться, таких, как хром, алюминий, титан, цирконий, никель, тантал и др. Пассивностью металла называется состояние его повышенной коррозионной устойчивости, вызванное торможением анодного процесса.
Механизм электрохимической коррозии. Коррозия металлов в средах, имеющих ионную проводимость, протекает через анодное окисление металлов
Me0 - ne- 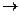 Me n+
Me n+
и катодное восстановление окислителя (Ox)
Ox + ne- 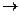 Red
Red
Наиболее часто при коррозии наблюдается восстановление молекул кислорода:
а) в нейтральной или щелочной среде: 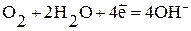 ;
;
б )в кислой среде: 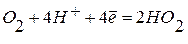 ;
;
и выделение водорода в кислой среде: 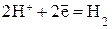 ,
,
Ионы или молекулы, которые восстанавливаются на катоде, называются деполяризаторами. При атмосферной коррозии - коррозия во влажном воздухе при комнатной температуре - деполяризатором является кислород (коррозия с кислородной деполяризацией). Коррозия с участием ионов водорода называется коррозией с выделением водорода (коррозия с водородной деполяризацией).
Пример 1.Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральном и кислом растворе. Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Решение. Цинк имеет более отрицательный стандартный электродный потенциал ( 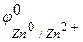 =-0,763 В), чем кадмий (
=-0,763 В), чем кадмий ( 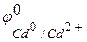 = -0,403 В), поэтому он является анодом, а кадмий – катодом, возникает микрогальванопара:
= -0,403 В), поэтому он является анодом, а кадмий – катодом, возникает микрогальванопара:
(А) Zn/ среда / Cd (К)
| Анодный процесс: | А: 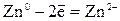
|
| Катодный процесс: а) в кислой среде б) в нейтральной среде | К: 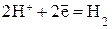 К:
К: 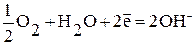
|
а) в кислой среде образуется соль цинка и газообразный водород
б) Так как ионы Zn2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом коррозии в нейтральной среде будет Zn(ОН)2.
ЭДС системы равна разности потенциалов окислителя и восстановителя:
Е. = 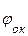 -
- 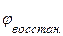 =
= 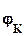 -
- 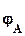 ,
,
то коррозия возможна при условии, что потенциал окислителя положительнее потенциала металла: 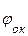 >
> 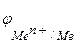 . Чем больше разность потенциалов, тем быстрее протекает коррозия, т.к. возрастает энергия Гиббса:
. Чем больше разность потенциалов, тем быстрее протекает коррозия, т.к. возрастает энергия Гиббса: 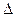 G = - E∙n∙F,
G = - E∙n∙F,
где Е - ЭДС (Е) элемента в [В]; n – число электронов, принимающих участие в электродном процессе, F = 96500 Кл/моль=96500 Дж/моль В – число Фарадея.
Если ЭДС элемента имеет положительное значение (Е>0), то коррозия возможна, т.к. 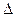 G < 0, а процесс протекает самопроизвольно.
G < 0, а процесс протекает самопроизвольно.
| <== предыдущая страница | | | следующая страница ==> |
| Технологии учебного процесса | | | ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ. Защита металлов от коррозии: легирование металлов, защитные покрытия, электрохимическая защита (протекторная) |
Дата добавления: 2014-05-04; просмотров: 608; Нарушение авторских прав

Мы поможем в написании ваших работ!