
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Электронные конфигурации элементов
| Период | Порядковый номер | Элемент | Электронная конфигурация |
| H | 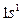
| ||
| He | 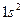
| ||
| Li | 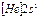
| ||
| Be | 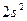
| ||
| B | 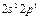
| ||
| C | 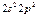
| ||
| N | 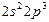
| ||
| O | 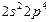
| ||
| F | 
| ||
| Ne | 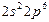
| ||
| Na | 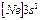
| ||
| Mg | 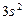
| ||
| Al | 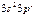
| ||
| Si | 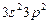
| ||
| P | 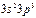
| ||
| S | 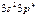
| ||
| Cl | 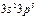
| ||
| Ar | 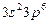
| ||
| K | 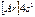
| ||
| Ca | 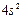
| ||
| Sс | 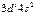
| ||
| Ti | 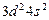
| ||
| V | 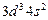
| ||
| Cr | 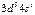
| ||
| Mn | 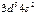
| ||
| Fe | 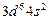
| ||
| Co | 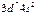
| ||
| Ni | 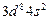
| ||
| Cu | 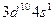
| ||
| Zn | 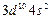
| ||
| Ga | 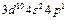
| ||
| Ge | 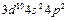
| ||
| As | 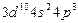
| ||
| Se | 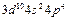
| ||
| Br | 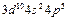
| ||
| Kr | 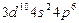
|
Продолжение
| Период | Порядковый номер | Элемент | Электронная конфигурация |
| Rb | 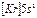
| ||
| Sr | 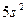
| ||
| Y | 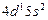
| ||
| Zr | 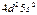
| ||
| Nb | 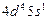
| ||
| Mo | 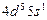
| ||
| Tc | 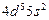
| ||
| Ru | 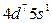
| ||
| Rh | 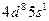
| ||
| Pd | 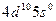
| ||
| Ag | 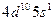
| ||
| Cd | 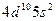
| ||
| In | 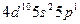
| ||
| Sn | 
| ||
| Sb | 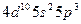
| ||
| Te | 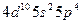
| ||
| I | 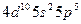
| ||
| Xe | 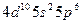
| ||
| Cs | 
| ||
| Ba | 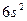
| ||
| La | 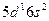
| ||
| Ce | 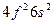
| ||
| Pr | 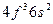
| ||
| Nd | 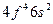
| ||
| Pm | 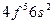
| ||
| Sm | 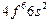
| ||
| Eu | 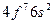
| ||
| Gd | 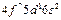
| ||
| Tb | 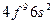
| ||
| Dy | 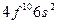
| ||
| Ho | 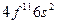
| ||
| Er | 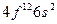
| ||
| Tm | 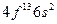
| ||
| Yb | 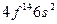
| ||
| Lu | 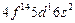
| ||
| Hf | 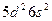
| ||
| Ta | 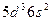
|
Продолжение
| Период | Порядковый номер | Элемент | Электронная конфигурация |
| W | 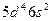
| ||
| Re | 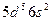
| ||
| Os | 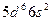
| ||
| Ir | 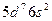
| ||
| Pt | 
| ||
| Au | 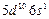
| ||
| Hg | 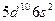
| ||
| Tl | 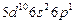
| ||
| Pb | 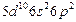
| ||
| Bi | 
| ||
| Po | 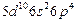
| ||
| At | 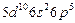
| ||
| Rn | 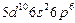
| ||
| Fr | 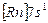
| ||
| Ra | 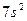
| ||
| Ac | 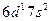
| ||
| Th | 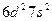
| ||
| Pa | 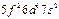
| ||
| U | 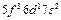
| ||
| Np | 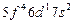
| ||
| Pu | 
| ||
| Am | 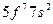
| ||
| Cm | 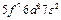
| ||
| Bk | 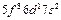
| ||
| Cf | 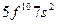
| ||
| Es | 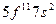
| ||
| Fm | 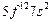
| ||
| Md | 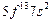
| ||
| (No) | 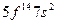
| ||
| (Lr) | 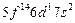
| ||
| (Ku) | 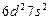
| ||
| (Ns) | 
| ||
| Rf | 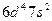
| ||
| Bh | 
| ||
| Hn | 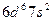
| ||
| Mt | 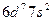
|
Содержание
1. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ.. 3
1.1. Определение химии. Предмет химии. Её связь с другими науками. Значение химии в изучении природы и развитии техники. 3
1.2. Основные понятия химии. 4
1.3. Основные законы химии. 7
2. СОВРЕМЕННАЯ ТЕОРИЯ СТРОЕНИЯ АТОМА. ПЕРИОДИЧЕСКИЙ ЗАКОН И СИСТЕМА ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕВА.. 10
2.1. Общие положения. 10
2.2. Развитие представлений о строении атома. 11
2.3. Квантово – механическая модель атома водорода. Исходные представления квантовой механики 13
2.4. Модель состояния электрона в атоме. 14
2.5. Квантовые числа. 15
2.6. Электронные конфигурации (формулы) элементов. 19
2.7. Порядок заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах 20
2.8. Электронные семейства элементов. 22
2.9. Понятие об электронных аналогах. 22
2.10. Периодический закон и периодическая система элементов Д.И. Менделеева. 23
2.11. Структура периодической системы химических элементов Д. И. Менделеева. 24
2.12. Периодическая система Д.И. Менделеева и электронная структура атомов. 26
2.13. Периодичность свойств элементов. 29
3.ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ.. 36
3.1. Основные понятия и определения. 36
3.2. Теория метода валентных связей. 38
3.3. Ковалентная связь. 39
3.4. Насыщаемость ковалентной связи. 41
3.5. Направленность ковалентной связи …………………………………………………………45
3.6. Полярность и поляризуемость химической связи. 54
3.7. Полярность молекул (типы ковалентных молекул) 57
3.8. Ионная связь. 59
3.9. Металлическая связь. 61
4. ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.. 64
4.1. Классификация веществ. 64
4.2. Оксиды.. 64
4.3. Гидроксиды.. 66
4.4. Кислоты.. 67
4.5. Основания. 69
4.6. Соли. 70
5. ЭНЕРГЕТИКА И НАПРАВЛЕННОСТЬ ХИМИЧЕСКИХ ПРОЦЕССОВ (ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ) 75
5.1 Основные понятия и определения. 75
5.2. Первый закон термодинамики. 77
5.3. Тепловой эффект химической реакции. Термохимия. Закон Гесса. 78
5.5. Свободная энергия Гиббса. 81
5.6. Свободная энергия Гельмгольца. 83
6. ХИМИЧЕСКАЯ КИНЕТИКА.. 84
6.1. Основные понятия химической кинетики. 84
6.2. Влияние природы реагирующих веществ. 85
6.3. Закон действующих масс. 85
6.4. Зависимость скорости химической реакции от температуры.. 87
6.5. Влияние катализатора. 90
7. ХИМИЧЕСКОЕ РАВНОВЕСИЕ.. 92
7.1. Общие представления о химическом равновесии. Константа химического равновесия 92
7.2. Смещение химического равновесия. Принцип Ле Шателье. 94
7.3. Фазовые равновесия. Правило фаз Гиббса. 96
8. ДИСПЕРСНЫЕ СИСТЕМЫ. РАСТВОРЫ... 99
8.1. Дисперсные системы и их классификация. 99
8.2. Общая характеристика растворов. 100
8.3. Способы выражения концентрации растворов. 101
8.4. Растворимость. 102
8.5. Природа жидких растворов. 104
8.6. Типы и свойства растворов. 105
8.7. Свойства растворов неэлектролитов. 107
8.8. Растворы электролитов. 112
8.9. Равновесия и обменные реакции в растворах электролитов. 119
8.10. Гидролиз солей. 133
8.11. Комплексные соединения. 143
9. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ.. 152
9.1. Общие понятия и определения. 152
9.2. Восстановители и окислители. 158
9.3. Влияние среды на окислительно-восстановительные реакции. 161
9.4. Типы окислительно-восстановительных реакций. 164
9.5. Окислительно – восстановительные (электродные) потенциалы.. 165
9.6. Направление протекания окислительно-восстановительных реакций. 169
10. Электрохимические процессы... 171
10.1. Гальванические элементы (химические источники электрического тока) 171
10.2. Электролиз. 175
10.3. Коррозия металлов. 184
10.4. Защита металлов от коррозии. 191
11. СВОЙСТВА МЕТАЛЛОВ.. 196
11.1. Физические свойства металлов. 196
11.2. Химические свойства металлов. 198
ЛИТЕРАТУРА.. 203
Приложение 1. 203
Электронные конфигурации элементов. 203
Содержание. 203
Учебное издание
Севастьянова Галина Константиновна Карнаухова Тамара Михайловна
ОБЩАЯ ХИМИЯ
Курс лекций
Редактор В.К. Бородина
Подписано к печати Бум. ГОЗНАК
Заказ № Уч.-изд. л.
Формат 60x84 1/16 Усл-печ. л.
Отпечатано на RISO GR 3750 Тираж 200 жз.
 Издательство «Нефтегазовый университет»
Издательство «Нефтегазовый университет»
Государственного образовательного учреждения высшего профессионального образования «Тюменский государственный нефтегазовый университет»
625000, Тюмень, ул. Володарского, 38
Отдел оперативной полиграфии издательства «Нефтегазовый университет» 625000, Тюмень, ул. Володарского, 38
[1] Если закон Авогадро применим только для газов, то число Авогадро имеет универсальный характер для любого агрегатного состояния вещества.
[2] Все рассмотренные газовые законы строго соблюдаются при очень малых давлениях, при обычных невысоких давлениях они соблюдаются приближенно, а при высоких давлениях наблюдаются большие отклонения от этих законов.
1 Представление об электронных семействах элементов и их валентных электронах см. в разделе 2.8.
1 Валентные электроны атома – это электроны, способные участвовать в образовании химических связей в молекулах, ионах и т.д.
1 Приведены эффективные радиусы, экспериментально найденные для металлического состояния простых веществ.
2 В этом случае f-сжатие называется лантаноидным.
1 В скобках указано число электронов на внешнем энергетическом уровне иона.
[3] Реакция протекает в расплаве веществ.
1 Реакция протекает в расплаве веществ.
2 Реакция протекает в расплаве веществ.
3 Реакция протекает в растворе.
1 Массовая и молярные доли могут быть выражены в промилле, %О (умножением на 1000), в частях на миллион, ppm (умножением на 106) и в частях на миллиард, ppb (умножением на 109).
1 От латинских слов Reductio (восстановление) и Oxidato (окисление).
1 Электролитический ключ – U-образная трубка, заполненная каким-либо электролитом, чаще – насыщенным раствором хлорида калия.
1 Механизм возникновения электродных потенциалов изложен в разделе 9.5.
1 Деполяризация – связывание электронов.
2 Деаэрацию можно осуществить кипячением раствора или его продуванием инертным газом.
| <== предыдущая страница | | | следующая страница ==> |
| Очень разб | | | Общий уход |
Дата добавления: 2014-09-29; просмотров: 467; Нарушение авторских прав

Мы поможем в написании ваших работ!