
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Рецепторы клеточной адгезии
Важнейшими рецепторами поверхности клеток животных, ответственными за узнавание клетками друг друга и их связывание, являются рецепторы адгезии. Они необходимы для регуляции морфогенетических процессов в ходе эмбрионального развития и поддержания стабильности тканей у взрослого организма.
Способность к специфическому взаимному узнаванию позволяет клеткам разных типов ассоциироваться в определенные пространственные структуры, свойственные различным этапам онтогенеза животных. При этом клетки зародыша одного типа взаимодействуют между собой и отделяются от других, отличающихся от них клеток. По мере развития зародыша изменяется характер адгезионных свойств клеток, что лежит в основе таких процессов, как гаструляция, нейруляция и формирование сомитов. У ранних эмбрионов животных, например у амфибий, адгезионные свойства поверхности клеток выражены настолько сильно, что способны восстанавливать исходное пространственное расположение клеток разных типов (эпидермиса, нервной пластинки и мезодеры) даже после их дезагрегации и перемешивания (рис. 12).
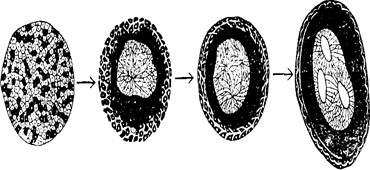
Рис.12. Восстановление структур эмбриона после дезагрегации
В настоящее время идентифицировано несколько семейств рецепторов, участвующих в клеточной адгезии. Многие из них принадлежат к семейству иммуноглобулинов, обеспечивающих Са++-независимое межклеточное взаимодействие. Рецепторы, входящие в это семейство, характеризуются наличием общей структурной основы – одного или нескольких доменов из аминокислотных остатков, гомологичных иммуноглобулинам. Пептидная цепь каждого из таких доменов содержит около 100 аминокислот и свернута в структуру из двух антипараллельных β-слоев, стабилизированных дисульфидной связью. На рис.13 изображена структура некоторых рецепторов семейства иммуноглобулинов.
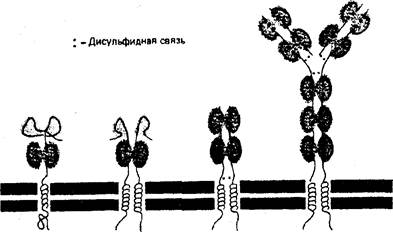
Гликопротеин Гликопротеин Т-клеточный Иммуноглобулин
МНС класса I МНС класса II рецептор
Рис.13. Схематическое изображение структуры некоторых рецепторов семейства иммуноглобулинов
К рецепторам этого семейства относятся, в первую очередь, рецепторы, опосредующие иммунный ответ. Так, происходящее в ходе иммунной реакции взаимодействие трех типов клеток – В-лимфоцитов, Т-хелперов и макрофагов обусловлено связыванием рецепторов клеточной поверхности этих клеток: Т-клеточного рецептора и гликопротеинов МНС класса II (главного комплекса гистосовместимости).
Структурно сходными и филогенетически родственными иммуноглобулинам являются рецепторы, участвующие в узнавании и связывании нейронов, так называемые молекулы адгезии нервных клеток (cell adhesion molecules, N-САМ). Они представляют собой интегральные монотопные гликопротеиды, одни из которых ответственны за связывание нервных клеток, другие – за взаимодействие нервных клеток и клеток глии. У большинства молекул N-САМ внеклеточная часть полипептидной цепи одинакова и организована в виде пяти доменов, гомологичных доменам иммуноглобулинов. Различия между молекулами адгезии нервных клеток касаются главным образом структуры трансмембранных участков и цитоплазматических доменов. Существует, по меньшей мере, три формы N-САМ, каждая из которых кодируется отдельной мРНК. Одна из этих форм не пронизывает липидный бислой, поскольку не содержит гидрофобного домена, а соединяется с плазматической мембраной только благодаря ковалентной связи с фосфатидилинозитолом; другая форма N-САМ секретируется клетками и встраивается во внеклеточный матрикс (рис.14).
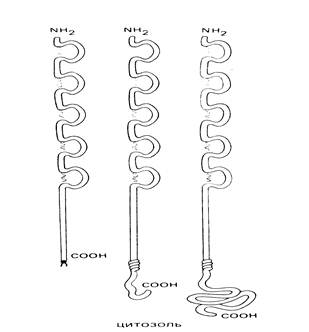
Фосфатидилинозитол
Рис.14. Схематическое изображение трех форм N-САМ
Процесс взаимодействия между нейронами заключается в связывании рецепторных молекул одной клетки с идентичными молекулами другого нейрона (гомофильное взаимодействие), причем антитела к белкам этих рецепторов подавляют нормальную селективную адгезию клеток одного типа. Основную роль в функционировании рецепторов играют белок-белковые взаимодействия, углеводам же отводится регуляторная функция. Некоторые формы САМ осуществляют гетерофильное связывание, при котором адгезия соседних клеток обеспечивается различными поверхностными белками.
Предполагается, что сложная картина взаимодействия нейронов в процессе развития мозга обусловлена не участием большого числа высокоспецифических молекул N-САМ, а дифференциальной экспрессией и посттрансляционными модификациями структуры небольшого числа адгезивных молекул. В частности, известно, что при развитии отдельного организма разные формы молекул адгезии нервных клеток экспрессируются в разное время и в различных местах. Кроме того, регуляция биологических функций N-САМ может осуществляться путем фосфорилирования сериновых и треониновых остатков в цитоплазматическом домене белков, модификаций жирных кислот в липидном бислое или олигосахаридов на поверхности клетки. Показано, например, что при переходе от эмбрионального мозга к мозгу взрослого организма значительно уменьшается число остатков сиаловой кислоты в гликопротеидах N-САМ, вызывая возрастание адгезивности клеток.
Таким образом, благодаря опосредованной рецепторами способности иммунных и нервных клеток к узнаванию формируются уникальные клеточные системы. При этом если сеть нейронов относительно жестко фиксирована в пространстве, то непрерывно перемещающиеся клетки иммунной системы лишь временно взаимодействуют друг с другом. Однако, N-САМ не только «склеивают» клетки и регулируют межклеточную адгезию в процессе развития, но и стимулируют рост нервных отростков (например, рост аксонов сетчатки). Более того, N-САМ временно экспрессируется во время критических стадий в развитии многих не нервных тканей, где эти молекулы способствуют удержанию вместе специфических клеток.
Гликопротеиды клеточной поверхности, не принадлежащие к семейству иммуноглобулинов, но имеющие некоторое структурное сходство с ними, образуют семейство рецепторов межклеточной адгезии, называемых кадгеринами. В отличие от N-САМ и других иммуноглобулиновых рецепторов, они обеспечивают взаимодействие контактирующих плазматических мембран соседних клеток только в присутствии внеклеточных ионов Са++. В клетках позвоночных экспрессируется более десяти белков, относящихся к семейству кадгеринов, все они являются трансмембранными белками, однократно проходящими через мембрану (табл.8). Аминокислотные последовательности разных кадгеринов гомологичны, причем каждая из полипептидных цепей содержит пять доменов. Аналогичная структура обнаруживается также у трансмембранных белков десмосом – десмоглеинов и десмоколлинов.
Клеточная адгезия, опосредованная кадгеринами, имеет характер гомофильного взаимодействия, при котором димеры, выступающие над поверхностью клеток, плотно соединяются в антипараллельной ориентации. В результате такого «сцепления» в зоне контакта формируется непрерывная кадгериновая молния. Для связывания кадгеринов соседних клеток необходимы внеклеточные ионы Са++; при их удалении происходит разделение тканей на отдельные клетки, в его присутствии – реагрегация диссоциированных клеток.
Таблица 8
Типы кадгеринов и их локализация
| Тип кадгерина | Локализация |
| Е-кадгерин | Многие эпителиальные клетки, клетки яичника, плаценты, почек |
| N-кадгерин | Нервные клетки, клетки сердечной мышцы, хрусталика |
| Р-кадгерин | Клетки плаценты и эпидермиса |
| R-кадгерин | Клетки сетчатки |
| Десмоглеины и десмоколлины | Клетки сердечной мышцы, эпителиальные клетки |
На сегодняшний день лучше всех охарактеризован Е-кадгерин, играющий важную роль в скреплении клеток различных эпителиев. В зрелых эпителиальных тканях при его участии связываются и удерживаются вместе актиновые филаменты цитоскелета, а в ранние периоды эмбриогенеза он обеспечивает компактизацию бластомеров.
Клетки в тканях контактируют, как правило, не только с другими клетками, но и с нерастворимыми внеклеточными компонентами матрикса. Наиболее обширный внеклеточный матрикс, где клетки расположены достаточно свободно, встречается в соединительных тканях. В отличие от эпителиев, здесь клетки прикреплены к компонентам матрикса, в то время как соединения между отдельными клетками не столь существенны. В этих тканях внеклеточный матрикс, окружая со всех сторон клетки, образует их каркас, способствует поддержанию многоклеточных структур и определяет механические свойства тканей. Помимо выполнения этих функции он участвует в таких процессах, как передача сигналов, миграция и рост клеток.
Внеклеточный матрикс представляет собой сложный комплекс различных макромолекул, которые локально секретируются клетками, соприкасающимися с матриксом, главным образом фибробластами. Они представлены полисахаридами гликозаминогликанами, обычно ковалентно связанными с белками в форме протеогликанов и фибриллярными белками двух функциональных типов: структурными (например, коллагеном) и адгезивными. Гликозаминогликаны и протеогликаны образуют в водной среде внеклеточные гели, в которые погружены коллагеновые волокна, укрепляющие и упорядочивающие матрикс. Адгезивные белки – крупные гликопротеиды, обеспечивающие прикрепление клеток к внеклеточному матриксу.
Особой специализированной формой внеклеточного матрикса является базальная мембрана – прочная тонкая структура, построенная из коллагена типа IV, протеогликанов и гликопротеидов. Она расположена на границе между эпителием и соединительной тканью, где служит для прикрепления клеток; отделяет от окружающей ткани отдельные мышечные волокна, жировые и шванновские клетки и т.д. При этом роль базальной мембраны не ограничивается лишь опорной функцией, она служит избирательным барьером для клеток, влияет на клеточный метаболизм, вызывает дифференцировку клеток. Чрезвычайно важным является ее участие в процессах регенерации тканей после повреждения. При нарушении целостности мышечной, нервной или эпителиальной ткани сохранившаяся базальная мембрана выступает в качестве субстрата для миграции регенерирующих клеток.
В прикреплении клеток к матриксу участвуют особые рецепторы, относящиеся к семейству так называемых интегринов (интегрируют и переносят сигналы от внеклеточного матрикса к цитоскелету). Связываясь с белками внеклеточного матрикса, интегрины определяет форму клетки и ее движение, что имеет решающее значение для процессов морфогенеза и дифференцировки. Интегриновые рецепторы встречается во всех клетках позвоночных, некоторые из них присутствуют во многих клетках, другие обладают достаточно высокой специфичностью.
Интегрины представляют собой белковые комплексы, содержащие два типа негомологичных субъединиц (α и β), причем многие интегрины характеризуются сходством в структуре β-субъединиц. В настоящее время идентифицировано 16 разновидностей α- и 8 разновидностей β- субъединиц, комбинации которых образуют 20 видов рецепторов. Все разновидности интегриновых рецепторов построены принципиально одинаково. Это трансмембранные белки, одновременно взаимодействующие с белком внеклеточного матрикса и с белками цитоскелета. С молекулой адгезивного белка связывается наружный домен, в котором участвуют обе полипептидные цепи. Некоторые интегрины способны связываться одновременно не с одним, а с несколькими компонентами внеклеточного матрикса. Гидрофобный домен прошивает плазматическую мембрану, а цитоплазматический С-концевой участок непосредственно контактирует с субмембранными компонентами (рис.15). Помимо рецепторов, обеспечивающих связывание клеток с внеклеточным матриксом, существуют интегрины, участвующие в формировании межклеточных контактов – внутриклеточные молекулы адгезии.
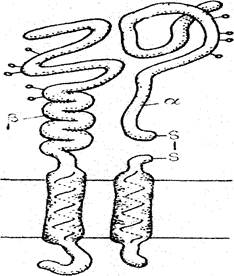
Рис.15. Строение интегринового рецептора
При связывании лигандов происходит активация интегриновых рецепторов и их скопление в отдельных специализированных участках плазматической мембраны с формированием плотно упакованного белкового комплекса, называемого фокальным контактом (адгезионной пластинкой). В нем интегрины с помощью своих цитоплазматических доменов соединены с цитоскелетными белками: винкулином, талином и др., которые связаны, в свою очередь, с пучками актиновых филаментов (рис.16). Такая адгезия структурных белков стабилизирует контакты клеток с внеклеточным матриксом, обеспечивает подвижность клеток, а также регулирует форму и изменение свойств клеток.
У позвоночных одним из важнейших белков адгезии, с которым связываются интегриновые рецепторы, является фибронектин. Он обнаруживается на поверхности клеток, например фибробластов, или свободно циркулирует в плазме крови. В зависимости от свойств и локализации фибронектина различают три его формы. Первая – растворимая димерная форма, называемая фибронектином плазмы, циркулирует в крови и тканевых жидкостях, способствуя свертыванию крови, заживлению ран и фагоцитозу; вторая образует олигомеры, временно прикрепляющиеся к поверхности клеток (поверхностный фибронектин); третья – это труднорастворимая фибриллярная форма, расположенная во внеклеточном матриксе (матриксный фибронектин).
Внеклеточный матрикс
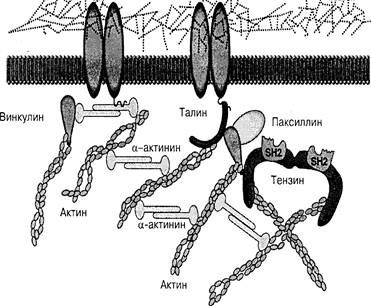
Рис.16. Модель взаимодействия внеклеточного матрикса с цитоскелетными белками при участии интегриновых рецепторов
Функция фибронектина состоит в обеспечении адгезии между клетками и внеклеточным матриксом. Таким способом при участии интегриновых рецепторов достигается контакт между внутриклеточной и окружающей их средой. Кроме того, путем отложения во внеклеточном матриксе фибронектина осуществляется миграция клеток: прикрепление клеток к матриксу действует как механизм, направляющий клетки к месту их назначения.
Фибронектин – это димер, состоящий из двух сходных по строению, но не идентичных полипептидных цепей, соединенных вблизи карбоксильного конца дисульфидными связями. Каждый мономер имеет участки связывания с клеточной поверхностью, гепарином, фибрином и коллагеном (рис.17). Для связывания наружного домена интегринового рецептора с соответствующим участком фибронектина требуется присутствие ионов Са2+. Взаимодействие цитоплазматического домена с фибриллярным белком цитоскелета актином осуществляется при помощи белков талина, танзина и винкулина.
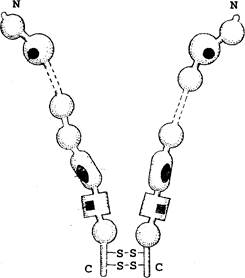
Рис.17. Схематическое строение молекулы фибронектина
Взаимодействие при помощи интегриновых рецепторов внеклеточного матрикса и элементов цитоскелета обеспечивает двустороннюю передачу сигнала. Как было показано выше, внеклеточный матрикс влияет на организацию цитоскелета в клетках-мишенях. В свою очередь, актиновые филаменты могут изменять ориентацию секретируемых молекул фибронектина, а их разрушение под влиянием цитохалазина приводит к дезорганизации молекул фибронектина и их отделению от клеточной поверхности.
Детально проанализирована рецепция с участием интегриновых рецепторов на примере культуры фибробластов. Оказалось, что в процессе прикрепления фибробластов к субстрату, протекающем при наличие в среде или на его поверхности фибронектина, рецепторы перемещаются, образуя скопления (фокальные контакты). Взаимодействие интегриновых рецепторов с фибронектином в области фокального контакта индуцирует, в свою очередь, формирование в цитоплазме клетки структурированного цитоскелета. Причем в его образовании решающую роль играют микрофиламенты, но участвуют и другие компоненты опорно-двигательго аппарата клетки – микротрубочки и промежуточные филаменты.
Рецепторы к фибронектину, содержащемуся в больших количествах в эмбриональных тканях, имеют большое значение в процессах клеточной дифференцировки. Считается, что именно фибронектин в период эмбрионального развития направляет миграцию в зародышах как позвоночных, так и беспозвоночных животных. В отсутствие фибронектина многие клетки теряют способность синтезировать специфические белки, а нейроны – способность к направленному росту. Известно, что в трансформированных клетках уровень фибронектина снижается, что сопровождается уменьшением степени их связывания с внеклеточной средой. В результате клетки приобретают большую подвижность, увеличивая вероятность метастазирования.
Другой гликопротеид, обеспечивающий сцепление клеток с внеклеточным матриксом при участии интегриновых рецепторов, называется ламинин. Ламинин, секретируемый главным образом эпителиальными клетками, состоит из трех очень длинных полипептидных цепей, расположенных в форме креста и соединенных дисульфидными мостиками. Он содержит несколько функциональных доменов, связывающих интегрины клеточной поверхности, коллаген ІV типа и другие компоненты внеклеточного матрикса. Взаимодействие ламинина и коллагена ІV типа, в больших количествах встречающихся в базальной мембране, служит для прикрепления к ней клеток. Поэтому ламинин присутствует, прежде всего, на той стороне базальной мембраны, которая обращена к плазматической мембране эпителиальных клеток, тогда как фибронектин обеспечивает связывание макромолекул матрикса и клеток соединительной ткани на противоположной стороне базальной мембраны.
Рецепторы двух особых семейств интегринов участвуют в агрегации тромбоцитов при свертывании крови и во взаимодействии лейкоцитов с эндотелиальными клетками сосудов. Тромбоциты экспрессируют интегрины, связывающие во время свертывания крови фибриноген, фактор Виллебранда и фибронектин. Такое взаимодействие способствует адгезии тромбоцитов и формированию сгустка. Разновидности интегринов, присутствующих исключительно в лейкоцитах, позволяют клеткам прикрепляться в месте инфекции к эндотелию, выстилающему кровеносные сосуды, и проходить сквозь этот барьер.
Показано участие интегриновых рецепторов в процессах регенерации. Так, после перерезки периферического нерва аксоны могут регенирировать с помощью рецепторов мембраны конусов роста, образующихся на разрезанных концах. Ключевую роль в этом играет связывание интегриновых рецепторов с ламинином или комплексом ламинина с протеогликаном.
Следует заметить, что нередко подразделение макромолекул на компоненты внеклеточного матрикса и плазматической мембраны клеток является достаточно условным. Так, некоторые протеогликаны представляют собой интегральные белки плазматической мембраны: их сердцевинный белок может пронизывать бислой или ковалентно связываться с ним. Взаимодействуя с большинством компонентов внеклеточного матрикса, протеогликаны способствуют прикреплению клеток к матриксу. С другой стороны, компоненты матрикса также прикрепляются к клеточной поверхности с помощью специфических рецепторных протеогликанов.
Таким образом, клетки многоклеточного организма содержат определенный набор поверхностных рецепторов, позволяющих им специфически связываться с другими клетками или с внеклеточным матриксом. Для такого взаимодействиях каждая отдельная клетка использует много различных адгезивных систем, характеризующихся большим сходством молекулярных механизмов и высокой гомологичностью участвующих в них белков. Благодаря этому, клетки любого типа в той или иной степени обладают сродством друг к другу, что, в свою очередь, обеспечивает возможность одновременного соединения многих рецепторов со многими лигандами соседней клетки или внеклеточного матрикса. При этом животные клетки способны распознать относительно малые различия в поверхностных свойствах плазматических мембран и устанавливают лишь наиболее адгезивные из многих возможных контактов с другими клетками и матриксом. На разных стадиях развития животных и в разных тканях дифференциально экспрессируются различные рецепторные белки адгезии, определяя поведение клеток в эмбриогенезе. Эти же молекулы появляются на клетках, которые участвуют в восстановлении тканей после их повреждения.
| <== предыдущая страница | | | следующая страница ==> |
| Часть 3. Рецепторная функция мембран | | | Рецепторы для сигнальных молекул |
Дата добавления: 2014-10-02; просмотров: 529; Нарушение авторских прав

Мы поможем в написании ваших работ!