
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Комплексонометрическое титрование
15.3.1. Понятие о комплексонах
Комплексонометрическим титрованием называется титриметрический метод анализа, основанный на образовании хелатов при взаимодействии катионов металлов с комплексонами.
Комплексоны – органические соединения, в молекулах которых содержится большое число оснόвных донорных центров и кислотных функциональных групп, расположенных так, что при их взаимодействии с катионами металлов образуются высокоустойчивые внутрикомплексные соединения, содержащие не менее двух циклов.
В качестве оснόвных донорных центров в молекулах комплексонов выступают атомы азота, фосфора или серы; кислотные центры обычно представлены карбоксильными или фосфоновыми группами. Например:
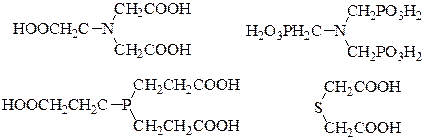
Максимально возможная дентатность у различных комплексонов может изменяться от 3 до 8:
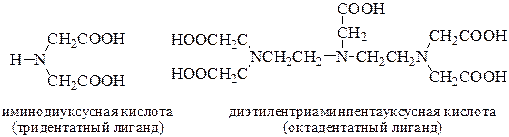
В титриметрии наибольшее значение имеют комплексоны, относящиеся к аминополикарбоновым кислотам: этилендиаминтетрауксусная кислота и её динатриевая соль.
15.3.2. Свойства этилендиаминтетрауксусной кислоты и её взаимодействие с катионами металлов
Этилендиаминтетрауксусная кислота (ЭДТА) представляет собой белое кристаллическое негигроскопичное вещество. Мало растворима в воде и этаноле. Растворимость ЭДТА в воде минимальна при рН 1,6 – 1,8 и увеличивается при уменьшении или увеличении рН.
ЭДТА (H6Y2+) является шестиосновной кислотой: pKa1 ~ 0,8; pKa2 ~ 1,6; pKa3 = 2,0; pKa4 = 2,67; pKa5 = 6,16; pKa6 = 10,26. Её нейтральная форма (H4Y) имеет цвиттер-ионную структуру.
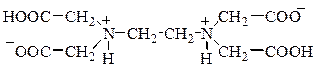
Отщепление первого и второго протонов у H4Y происходит от карбоксильных групп. У дианиона ЭДТА карбоксильные группы депротонированы, а атомы азота, наоборот, остаются протонированными. Третий и четвёртый протоны отщепляются от N-H кислотных центров. Анионы ЭДТА имеют сложное строение, так как протонизированные атомы водорода могут образовывать внутримолекулярные водородные связи –N-H…O, что приводит к формированию циклов.
На рис. 15.1 приведена зависимость состава водных растворов ЭДТА от рН.
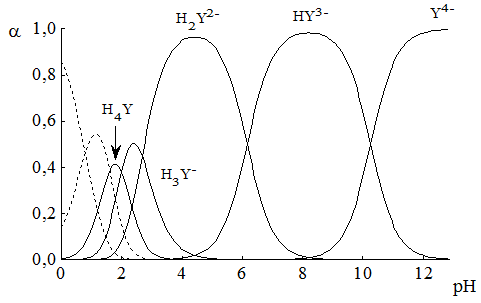
Рис. 15.1. Распределительная диаграмма для ЭДТА
При рН 3-6 в растворе доминирует анион H2Y2-, при рН 6-10 – HY3- а при рН > 10,5 – Y4-. В общем случае значение a(Y4-) можно рассчитать:
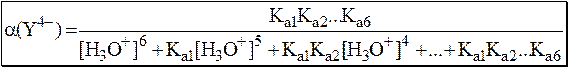
По мере увеличения рН формула для расчёта a(Y4-) будет упрощаться. Например, при рН > 8 можно принять, что
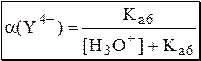 или
или 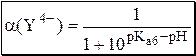
ЭДТА образует комплексы с катионами большинства металлов
Mn+ + HmY(m-4)- › [MY](n-4)+ + mH+
При рН 9 это уравнение будет выглядеть как
Mn+ + HY3- › [MY](n-4)+ + H+
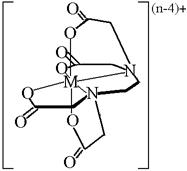 Рис. 15.2. Структура комплекса металла с ЭДТА
Рис. 15.2. Структура комплекса металла с ЭДТА
|
ЭДТА является гексадентатным лигандом и в подавляющем большинстве случаев взаимодействует с катионами металлов в молярном соотношении 1:1. В структуре образующегося внутрикомплексного соединения имеется 5 пятичленных циклов (рис. 15.2.), что делает его очень устойчивым. Устойчивость комплексов металлов с ЭДТА, как правило, повышается с увеличением заряда иона металла. Так ионы Cr3+, Al3+, Bi3+ или Fe3+ образуют комплексы, величины констант образования которых превышают 1020.
На устойчивость комплексов катионов металлов с ЭДТА влияют вещества, взаимодействующие с катионами металла либо с анионом Y4-.
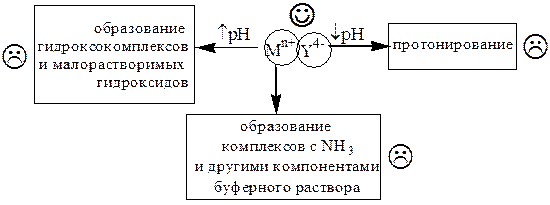
Практически устойчивость комплексов катионов металлов с ЭДТА удобно описывать с помощью условных констант образования, которые могут быть использованы лишь при тех условиях (рН, концентрация постороннего лиганда), для которых они рассчитаны.
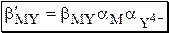
| <== предыдущая страница | | | следующая страница ==> |
| Общая характеристика. Комплексометрическое титрование – группа титриметрических методов анализа, основанных на реакциях образования растворимых комплексных соединений | | | Кривые титрования |
Дата добавления: 2014-10-10; просмотров: 692; Нарушение авторских прав

Мы поможем в написании ваших работ!