
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Кондуктометрическое титрование
Определение произведения растворимости (ПР) труднорастворимых соединений (электролитов).
Константа диссоциации электролита
Степень диссоциации электролитов
ПРИМЕНЕНИЕ КОНДУКТОМЕТРИИ
При помощи кондуктометрии можно определять ряд физико-химических величин электролитов:
a = 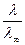 .
.
К = 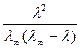 С.
С.
Из закона действующих масс следует, что для насыщенного раствора сильного электролита Кm Аn:
KmAn = mK+ + n A-
можно написать
[K+]m[A-]n = k[KmAn] = ПР.
В случае бинарного электролита, диссоциированного нацело
[K+] = [A-] = 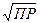 = С,
= С,
где С - растворимость данной соли в моль/л.
Измеряют электропроводность раствора, находящегося в равновесии с осадком малорастворимого сильного электролита. Зная подвижность ионов l+¥ и l-¥, на которые диссоциирует труднорастворимая соль в сильноразбавленном растворе, и, определив экспериментально удельную электропроводность À раствора, можно вычислить растворимость электролита.
С = 1000;
С = 1000(À-ÀН2О)/(l+¥+l-).
Этот метод позволяет определить эквивалентную точку при титровании
по измерению электропроводности. Изменение электропроводности при кондуктометрическом титровании связано с тем, что в ходе реакции образуются малодиссоциированные или малорастворимые соединения. Чувствительность кондуктометрического титрования зависит от разности в подвижностях связываемых и появляющихся ионов, причем она будет тем выше, чем больше эта разница. В связи с тем, что подвижность ионов Н+ и ОН- значительно превышают подвижности других ионов, кондуктометрическое титрование наиболее целесообразно применять для кислотно-основного титрования
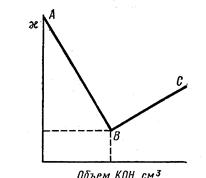
На рисунке показано изменение удельной электропроводности при титровании раствора сильной кислоты раствором сильного основания, например, соляной кислоты раствором КОН по реакции
HCl + KOH = KCl + H2O,
или в ионной форме
H+ + Cl- + K+ + OH- = H2O + K+ + Cl-.
По достижении эквивалентной (нейтральной) точки В, где электропроводность раствора имеет минимальное значение, снова наступает увеличение электропроводности, так как в раствор дополнительно продолжают поступать ионы калия и гидроксила.
| <== предыдущая страница | | | следующая страница ==> |
| ИЗМЕРЕНИЕ ЭЛЕКТРОПРОВОДНОСТИ | | | Электропроводность как метод физико-химического анализа |
Дата добавления: 2014-03-11; просмотров: 559; Нарушение авторских прав

Мы поможем в написании ваших работ!