
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Электропроводность как метод физико-химического анализа
В зависимости от характера взаимодействия молекул компонентов диаграммы состав - электропроводность имеют различный геометрический вид. По диаграммам можно судить о природе образующихся растворов и соединений.
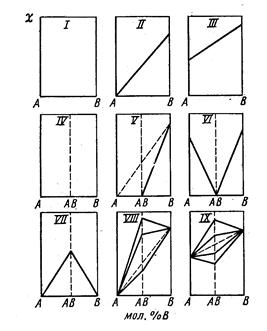
Диаграммы I – Ш отвечают случаям, когда отсутствуют взаимодействия между компонентами: I – оба компонента не проводят ток; П – один компонент (В) является проводником; Ш – оба компонента проводят ток. Диаграммы IV – VI соответствуют случаям образования непроводящего соединения АВ. Диаграммы VI – IX соответствуют образованиям проводящих соединений АВ.
7.3 ЭЛЕКТРОДВИЖУЩИЕ СИЛЫ И РАВНОВЕСНЫЕ ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
7.3.1 ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ И ЭЛЕКТРОЛИЗЕР. ЗАКОНЫ ЭЛЕКТРОЛИЗА
При протекании окислительно-восстановительных реакций электроны от вещества-восстановителя переходят к веществу-окислителю. При этом химическая энергия освобождается в виде теплоты. Если же окислитель отделить от восстановителя каким-либо третьим раствором электролита и соединить их между собой металлическим проводником, то тогда реакция восстановления будет протекать на одном конце металлического проводника, реакция окисления на другом, а электроны, освобождающиеся при реакции .окисления, будут перетекать по металлу к окислителю. При этом химическая энергия реакции будет превращаться в электрическую.
Устройство, в котором химическая энергия самопроизвольно превращается в электрическую, называется химическим источником тока (ХИТ) или гальваническим элементом.
Гальванический элемент состоит из двух или нескольких соприкасающихся друг с другом растворов электролитов, в которые погружены металлические пластинки - электроды, соединенные между собой внешним проводником. Электрод, на котором протекает реакция восстановления, называется катодом, а электрод, на котором протекает реакция окисления, - анодом.
На катоде Ох + ze ® Red.
На аноде Red1 ® Ox1 + ze.
Суммарно Ox + Red1 ® Red + Ox1 .
Пример: элемент Даниэля-Якоби
на катоде Cu2+ + 2e ® Cu;
на аноде Zn ® Zn2+ + 2e;
Cu2+ + Zn ® Cu + Zn2+.
Электрический потенциал катода больше, чем анода. Поэтому принято говорить, что в гальваническом элементе потенциал катода положителен, а анода отрицателен. Разность потенциалов электродов равна напряжению, или ЭДС гальванического элемента.
Устройство, в котором за счет подводимой извне электрической энергии совершаются химические превращения, называется электролизером, или электролитической ванной. Электролизер заполняется одним раствором. Электроны поставляются на катод и отсасываются от анода внешним источником тока. Во внутренней цепи катионы движутся к катоду, анионы к аноду. Полярность электродов в электролизере противоположна таковой в гальваническом элементе, т.е. катод в электролизере отрицателен, а анод положителен.
Между количеством электричества, прошедшего через электролизер, и количеством прореагировавших на электродах веществ существует пропорциональность, установленная в 1833 г. Фарадеем.
Первый закон Фарадея устанавливает, что количество вещества, которое окисляется на аноде или восстанавливается на катоде, пропорционально количеству электричества, прошедшего через электролит.
m = kQ = kIt,
где m – масса вещества в граммах; Q – количество электричества; I – сила тока в амперах; t – время в секундах.
Согласно второму закону Фарадея масса веществ, выделенных при электролизе на электродах равными количествами электричества, пропорциональна их химическим эквивалентам. При протекании во внешней цепи 96491,4 кулонов (число Фарадея) на электродах выделяется 1г-экв веществ
- 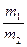 =
= 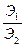 ;
;
Э = ;
K = ()();
m = 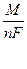 It.
It.
Расход электроэнергии при электролизе характеризуется выходом по току (h). Выход по току есть выраженное в процентах отношение количества фактически полученного вещества (m) на электроде к теоретически вычисленному количеству вещества (m0).
h = 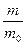 100.
100.
| <== предыдущая страница | | | следующая страница ==> |
| Кондуктометрическое титрование | | | ТЕРМОДИНАМИКА ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА |
Дата добавления: 2014-03-11; просмотров: 403; Нарушение авторских прав

Мы поможем в написании ваших работ!