
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ТЕРМОДИНАМИКА ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА
Независимо от того, протекает ли реакция по химическому или электрохимическому пути, энергетические изменения в системе остаются одинаковыми. Электрохимические реакции, подобно химическим, рассматривают с позиций термодинамики и кинетики. Если химическую реакцию проводить в гальваническом элементе с очень малой скоростью, т.е. так, чтобы процесс практически не отклонялся от равновесного, то полезная работа электрического тока окажется равной максимальной работе реакции
W = QE = -DG ,
где Q- количество протекающего электричества; Е - напряжение или ЭДС разомкнутого элемента в В.
При протекании химической реакции
aA + bB = cC + dD;
Ox + Red1 = Red + Ox1,
в процессе окисления участвуют n электронов
n = zn,
где n - стехиометрический коэффициент;
n -число электронов, отданных или принятых 1 частицей.
При окислении-восстановлении n г-экв веществ будет протекать кулонов электричества nF = Q;
W = nFE = -DG;
E = -.
Чем больше величина изобарно-изотермического потенциала реакции, тем больше напряжение элемента. Следовательно, электродвижущая сила, как и изобарный потенциал, является мерой химического сродства реагирующих веществ. Вспомним уравнение изотермы Вант-Гоффа
W = -DG = RTlnKa - RTln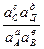 ,
,
подставив в него Е, получим
Е = 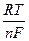 lnKa -
lnKa - 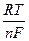 ln
ln ;
;
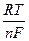 lnKa = E0,
lnKa = E0,
где E0 – ЭДС элемента, когда активности равны единице, называется стандартной ЭДС.
E = E0 - 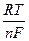 ln
ln - уравнение Нернста.
- уравнение Нернста.
7.3.2.2 ОПРЕДЕЛЕНИЕ ТЕРМОДИНАМИЧЕСКИХ ПАРАМЕТРОВ ХИМИЧЕСКОЙ РЕАКЦИИ
Для изменения энтропии имеется формула
-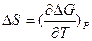 ;
;
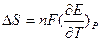 .
.
Зная изменение ЭДС от температуры, можно найти изменение энтропии реакции
DG = DH - TDS.
Отсюда можно найти изменение энтальпии реакции (тепловой эффект)
DH = DG + TDS = -nFE + 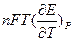 ,
,
где называется температурным коэффициентом ЭДС.
Таким образом, из измерения ЭДС гальванического элемента для ряда температур можно вычислить DG, DSи DH реакции, протекающей в элементе.
7.3.3 СКАЧКИ ПОТЕНЦИАЛА НА ГРАНИЦЕ РАЗДЕЛА ФАЗ
В ЭЛЕКТРОХИМИЧЕСКИХ СИСТЕМАХ
При соприкосновении двух разнородных фаз их частицы могут вступать в взаимодействие. При этом на границе раздела происходит упорядоченное распределение положительных и отрицательных зарядов. Одна фаза приобретает избыток положительных зарядов, а другая - отрицательных. В результате образуется двойной слой электрических зарядов с определенным скачком электрического потенциала в нем, подобно тому, как это происходит при зарядке электрического конденсатора. Двойной электрический слой возникает вследствие:
1) перехода электронов, катионов или анионов из одной фазы в другую;
2) адсорбции дипольных молекул, катионов или анионов из одной фазы на другой фазе.
Рассмотрим, какие скачки потенциалов встречаются в гальванических элементах на примере элемента Даниэля- Якоби
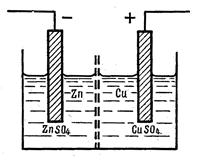
Здесь имеются разделы фаз: 1) металл 1 - металл 2; 2) металл – раствор электролита; 3) раствор электролита 1 - раствор электролита 2.
1. Контактный скачок потенциала возникает на границе двух металлов вследствие неравенства их работы выхода электрона. Часть электронов зоны проводимости от металлов с меньшей работой выхода перейдет к металлу с большей работой выхода. При этом первый металл зарядится положительно, а второй отрицательно. Величина внутреннего контактного потенциала находится в пределах 1 В.
2. Скачок потенциала на границе металл-раствор возникает вследствие перехода катионов металла в раствор или из раствора в металл. Если же металл электрода инертный и не способен отдавать катионы в раствор и в растворе нет катионов данного металла, то скачок потенциала может возникнуть, если в растворе имеется окисленная или восстановленная форма какого-либо другого вещества или обе его формы.
Перешедшие в раствор катионы или оставшиеся в растворе избыточные анионы под влиянием электрического поля заряженного металла расположатся вблизи металла и создадут так называемый двойной электрический слой.
3. Диффузионный скачок потенциала на границе раствор-раствор возникает вследствие неодинаковой подвижности катионов и анионов и градиента их концентраций. Ионы с большей подвижностью диффундируют в сторону второго электролита быстрее и образуют в растворе фронт одноименно заряженных ионов. Ионы с меньшей подвижностью удерживаются у этого фронта, образуя второй слой. В результате возникает двойной электрический слой со скачком потенциала.
Диффузионный потенциал обычно не превышает 40 мв. При точных измерениях ЭДС его устраняют, помещая между двумя растворами более концентрированный третий раствор электролита, у которого подвижности катионов и анионов практически одинаковы (обычно растворы КСl или NH4NO3).
7.3.4 ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
Способов измерения или расчета абсолютных значений электродных скачков потенциала пока не найдено. Однако ЭДС цепи, состоящей из двух или большего числа электродов, доступна прямому определению и равна алгебраической сумме всех межфазных скачков потенциала. В простейшем случае она равна разности двух электродных скачков потенциала, т.е. является мерой их относительных значений. Величина каждого из электродных скачков потенциала может быть принята за нулевую точку условной шкалы электродных потенциалов. Международным соглашением установлена шкала потенциалов, по которой скачок потенциала стандартного водородного электрода при всех температурах равен нулю.
Электродный скачок потенциала в условной шкале водородного электрода называется электродным потенциалом и обозначается j. Он равен ЭДС электрохимического элемента, состоящего из стандартного водородного иданного электродов. Запись такого элемента всегда начинается с водородного электрода, т.е. он считается левым. Форма записи и знак отдельного электрода определяются правилом, утвержденным конвенцией Международного союза по чистой и прикладной химии (Стокгольм,1953). По этому правилу слева записывается ионная форма реагирующего вещества, далее прочие фазы в той последовательности, в которой они соприкасаются друг с другом. Справа должен стоять символ молекулярной формы вещества, участвующего в электродной реакции, или химический символ металла. Фазы, нанесенные на поверхность металла, отделяются запятой, границы раздела жидких и твердых фаз отмечаются вертикальными черточками, если между ними нет диффузионного скачка потенциала. Активности веществ указываются в скобках.
Запись по данному правилу соответствует электродному скачку потенциала в направлении от раствора к металлу. Ему приписывается положительный знак и соответствует самопроизвольно протекающая восстановительная реакция. (Скачок потенциала в обратном направлении считается отрицательным, ему соответствует окислительная реакция). ЭДС элемента, состоящего из стандартного водородного электрода и электрода, в котором протекает реакция восстановления, будет, таким образом, положительной.
Согласно правилу водородный электрод запишется так:
Н+ (аН+) ½ Pt,H2 (PH2).
Стандартный водородный электрод, потенциал которого принят равным нулю и который всегда должен быть левым относительно другого электрода, записывается следующим образом:
H2 (PH2 = 1), Pt ½ H+ (aH+ = 1 ).
Цинковый электрод записывается в виде
Zn2+ (aZn2+) ½ Zn,
а потенциал этого электрода определяется ЭДС элемента
(+) H2 (PH2), Pt ½ H+ (aH+) ½½ Zn2+ (aZn2+) ½ Zn (-).
Опыт показывает, что при работе элемента цинк окисляется:
Zn = Zn2+ + 2e.
Значит, потенциалу цинкового электрода, должен быть приписан отрицательный знак. Абсолютная величина потенциала цинкового электрода равна
E = jZn2+/Zn + Dyд + jH+/H2
В отличии от цинкового электрода медный электрод имеет положительный потенциал, соответствующий положительной ЭДС элемента:
(—) H2 (PH2 = 1), Pt ½ H+ (aH+ = 1) ½½ Cu2+ (aCu2+) ½ Cu (+).
Здесь в медном электроде самопроизвольно идет восстановительная реакция.
При активностях ионов меди и цинка, равных единице, ЭДС соответствующих элементов определяют стандартные потенциалы медного и цинкового электродов. Стандартные электродные потенциалы образуют ряд, который применительно к системам металл - ионы металла в водном растворе - соответствует расположению металлов по их химической активности, т.е. ряду напряжений.
Разность потенциалов двух электродов в водородной шкале равна ЭДС элемента, составленного из этих электродов, и включает два электродных скачка потенциала и скачок потенциала металл 1 –металл 2,если диффузионный потенциал раствор 1 - раствор 2 пренебрежимо мал.
Для водородной шкалы потенциалов уравнение Нернста будет иметь вид
j = j0 + 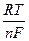 ln
ln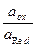 .
.
В частном случае, для электрода металл - ионы металла
j = j0 + 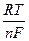 lnaMez+ = j0 +
lnaMez+ = j0 +  lg aMez+ ,
lg aMez+ ,
так как при Т =* 298 К aRed = aMe = 1.
7.3.5 КЛАССИФИКАЦИЯ ЭЛЕКТРОДОВ
В основу классификации электродов положено агрегатное состояние и растворимость окисленной и восстановленной формы веществ, участвующих в электродной реакции.
Электроды первого рода
Электродом первого рода называется металл или неметалл, погруженный в раствор, содержащий его ионы.
Примеры: медный электрод в растворе соли меди
Cu2+½Cu.
Электроды второго рода
Электрод второго рода состоит из металла, покрытого слоем его малорастворимого соединения и погруженного в раствор растворимой соли, содержащий тот же анион.
Примером служат каломельный и хлорсеребряный электроды:
Cl- ½ Hg2 Cl2, Hg;
Cl- ½ AgCl, Ag.
| <== предыдущая страница | | | следующая страница ==> |
| Электропроводность как метод физико-химического анализа | | | Окислительно-восстановительные электроды |
Дата добавления: 2014-03-11; просмотров: 790; Нарушение авторских прав

Мы поможем в написании ваших работ!