
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Окислительно-восстановительные электроды
Амальгамные электроды
Газовые электроды
Газовый электрод состоит из инертного металла (обычно платины), контактирующего одновременно с газом и раствором, содержащим ионы этого газообразного вещества.
Примером газовых электродов могут служить водородный, кислородный и хлорный электроды:
Н+ ½ H2, Pt.
Амальгамный электрод состоит из амальгамы данного металла (раствор металла в ртути) в контакте с раствором, содержащим ионы этого металла:
МеZ+ ½ Me, Hg.
Окислительно-восстановительный электрод состоит из инертного металла, погруженного в раствор, содержащий окисленную и восстановленную форму вещества:
Fe2+, Fe3+ ½ Pt.
7.3.6 ВОДОРОДНЫЙ ЭЛЕКТРОД
Этот электрод состоит обычно из платинированной платиновой пластинки опущенной в раствор, содержащий ионы водорода, и омываемый током газообразного водорода. (Платинированием называется покрытие поверхности слоем платиновой черни, т.е. слоем высокодисперсной платины, получаемой обычно электролитическим путем непосредственно на самой пластинке).
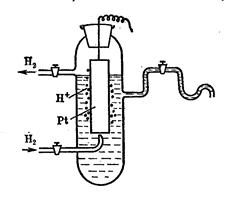
В водородном электроде происходит реакция
1/2Н2 = Н+ + е,
вполне аналогичная реакциям, протекающим на поверхности металлических электродов, обратимых относительно катиона. Платина здесь играет роль только инертного проводника и может быть заменена палладием, иридием, золотом и некоторыми другими металлами.
Электродный потенциал такого электрода зависит от концентрации ионов водорода в растворе, от давления водорода в газовой фазе и от температуры.
jН+ = j0Н+ + (lnaH+ - lnPH2),
для РН2 = 1 атм;
jН+ = lnaH+;
jH+ = 1,984×10-4 T lgaH+;
jH+ = - 1,984× 10-4 T (pH) .
Водородный электрод весьма чувствителен к условиям работы. Для получения вполне правильных и устойчивых результатов существенны, в частности, высокая степень чистоты водорода и состояние поверхности платины. При правильной работе, водородный электрод дает очень точные результаты, воспроизводимые до 0,00001 в. Но чувствительность его к условиям процесса сильно усложняет работу с ним. Поэтому обычно пользуются другими электродами, для которых потенциал по отношению к такому электроду известен и которые вместе с тем не так капризны в работе
| <== предыдущая страница | | | следующая страница ==> |
| ТЕРМОДИНАМИКА ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА | | | Потенциал его определяемся соотношением |
Дата добавления: 2014-03-11; просмотров: 561; Нарушение авторских прав

Мы поможем в написании ваших работ!