
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ЭЛЕКТРОДЫ И ЦЕПИ
На электродах всех гальванических элементов происходят реакции окисления или восстановления. Название же окислительно-восстановительных электродов применяется в более узком смысле.
Окислительно-восстановительными (или редокс) называются такие электроды или цепи, в которых материал электрода не изменяется, а лишь служит источником или приемником электронов, получаемых или отдаваемых веществами, восстанавливающимися или окисляющимися на поверхности электродов. Простым примером такого электрода может служить пластинка из платины, опущенная в раствор, содержащий хлорное железо FeCl3 и хлористое железо FeCl2. При сочетании такого электрода с каким-либо другим образуется гальванический элемент, в котором в зависимости от вида другого электрода происходит или окисление Fe2+ в Fe3+, или восстановление Fe3+ в Fe2+ .
Если другой электрод в элементе является положительным по отношению к окислительно-восстановительному, то реакция Fe2+ D Fe3+ будет проходить вправо (окисление),если же он является отрицательным, то реакция будет происходить влево (восстановление).
В сущности, отличием такого электрода от электродов, рассмотренных ранее, является то, что здесь продукты и окисления и восстановления остаются в растворе, а не выделяются на электроде. Потенциал такого электрода может быть определен по формуле
jFe2+/Fe3+ = j0Fe2+/Fe3+ + 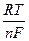
 ln
ln .
.
| <== предыдущая страница | | | следующая страница ==> |
| К цепям второго рода относятся цепи с газовыми или амальгамными электродами | | | Потенциометрическое определение рН |
Дата добавления: 2014-03-11; просмотров: 532; Нарушение авторских прав

Мы поможем в написании ваших работ!