
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Потенциометрическое определение рН
ПРИМЕНЕНИЕ ПОТЕНЦИОМЕТРИЧЕСКИХ МЕТОДОВ
Определение каких-нибудь свойств путем измерения ЭДС гальванических цепей того или другого вида называют потенциометрическими определениями. Наиболее важными из них можно назвать:
1. Определение термодинамических параметров химических реакций.
2. Определение растворимости малорастворимых электролитов.
3. Определение рН и потенциометрическое титрование.
Потенциал водородного электрода связан простым соотношением с активностью водородных ионов
. jН+ = lnaH+
и с водородным показателем среды рН
jН+ = -1,984×10-4 Т (рН),
что дает возможность определять аН+ и рН путем измерения ЭДС соответствующих цепей, содержащих водородный электрод. Наряду с водородным электродом для той же цели может служить хингидронный электрод, стеклянный и некоторые другие электроды.
Хингидронный электрод
Для измерения рН растворов широко применяется хинон-гидрохиноновый (хингидронный) редокс-электрод.
При рН <8 на платине протекает электродная реакция:
С6Н4О2 + 2Н+ + 2е = С6Н4(ОН)2;
jхинг = j0 + lg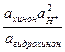 .
.
При измерении рН среды в испытуемый раcтвор, насыщенный эквимолекулярной смесью хинона и гидрохинона, погружают платиновую проволочку. Так как ахинон = агидрохинон уравнение принимает вид
jхинг = j0 + в0lg aH+ = 0,699 – в0 рН.
7.3.13 СТЕКЛЯННЫЙ ЭЛЕКТРОД
Этот электрод представляет собой стеклянную мембрану, разделяющую два раствора с различной концентрацией ионов водорода. При этом на поверхности стекла возникает скачок потенциала.
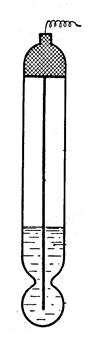
Стекло представляет coбой сетку, построенную из кремнийкислородных цепочек, пустоты которой заняты катионами щелочных металлов. Катионы, находящиеся в пустотах решетки, могут обратимо замениться без нарушения структуры решетки.
В возникновении водородной функции в растворах большую роль играет обмен ионов щелочных металлов, находящихся в промежутках кремнийкислородной решетки, на ионы из раствора, в который погружен стеклянный электрод. Стеклянный электрод отличается от других электродов тем, что в соответствующей ему электродной реакции не участвуют электроны. Электродная реакция сводится здесь к обмену ионами водорода между двумя фазами - раствором и стеклом:
Н+ = Н+ст.
Уравнение для потенциала стеклянного электрода запишется таким oбразом:
jст = j0 + 2,303 lg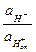 .
.
Уравнение реакции обмена будет следующим:
Ме+ст + Н+ = Ме+ + Н+ст ,
где ионы Ме+, в зависимости от состава стекла, могут быть ионы Na+ или К+.
Этому уравнению соответствует константа обмена
Кобм = 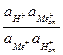 .
.
Если предположить, что в стекле данного сорта сумма активностей ионов водорода и щелочного металла постоянна аН+ст + аМе+ст = а, то константа обмена примет вид
Кобм = 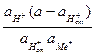 .
.
Решение относительно 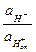 дает
дает
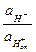 =
= 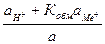 .
.
Подстановка в уравнение для электродного потенциала дает
jст = j0ст + в0 lg(aH+ + KобмаМе+),
где величина 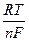 lna включена в стандартный потенциал стеклянного электрода.
lna включена в стандартный потенциал стеклянного электрода.
Для обычных стеклянных электродов величина Кобм находится в пределах 10-1 – 10-15.
В кислых растворах аН+ > КобмаМе+ и уравнение имеет вид
jст = j0ст + в0lgaH+ = j0ст – рН.
В таких растворах потенциал стеклянного электрода зависит только от активных водородных ионов и может служить индикаторным электродом при определении рН и кислотно-щелочном титровании.
Когда аН+< КобмаМе+, то есть в щелочной среде уравнение также упрощается:
jст = j0ст + в0lgaMe+ ,
где в величину j0ст входит в0lgK.
Если источником катионов служит раствор щелочи, то аМе+ = аОН- , а так как
аН+×аОН- = к , то для щелочных растворов получим уравнение
jст = j0ст + в0рН.
7.3.14 ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Под термином потенциометрическое титрование объединяют методы определения конечной точки на основе зависимости потенциал - объем добавленного титранта в исследуемую среду.
В зависимости от типа реакции методы потенциометрического титрования делятся на методы осаждения, нейтрализации, комплексообразования и окислительно-восстановительные методы.
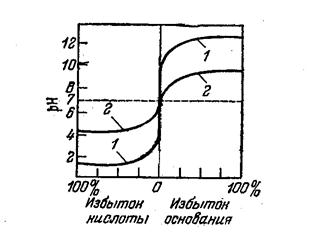
На рисунке приведены кривые титрования метода нейтрализации в зависимости от силы кислот и оснований.
| <== предыдущая страница | | | следующая страница ==> |
| ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ЭЛЕКТРОДЫ И ЦЕПИ | | | ПОЛЯРИЗАЦИЯ |
Дата добавления: 2014-03-11; просмотров: 509; Нарушение авторских прав

Мы поможем в написании ваших работ!