
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Способы обнаружения конечной точки титрования. Окислительно-восстановительные индикаторы
Конечную точку окислительно-восстановительного титрования обнаруживают визуальным путём либо с помощью различных инструментальных методов, например, потенциометрически. Визуальное обнаружение может быть проведено по собственной окраске одного из участников протекающей при титровании химической реакции либо с помощью индикаторов.
Индикаторы, используемые для обнаружения конечной точки окислительно-восстановительного титрования, могут быть:

Окислительно-восстановительные индикаторы - вещества, способные окисляться или восстанавливаться с изменением окраски в точке эквивалентности либо вблизи неё. Такие индикаторы реагируют не на изменение концентрации определённого вещества, а на изменение потенциала системы.
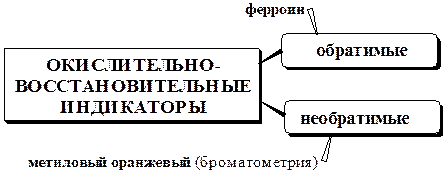
Наиболее часто применяемыми окислительно-восстановительными индикаторами являются дифениламин и его производные, а также хелаты ионов железа с фенантролином или с замещёнными фенантролинами.
Дифениламин
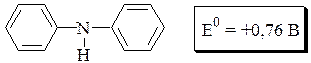
Дифениламин малорастворим в воде (для приготовления его растворов используют концентрированную серную кислоту). Более удобными для практического применения являются водорастворимые аналоги дифениламина, применяемые в виде различных солей.
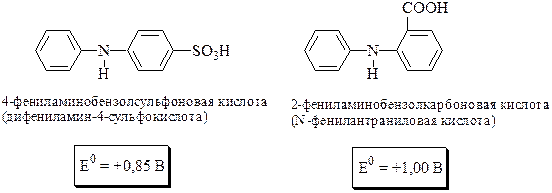
Окисление дифениламина протекает в 2 стадии
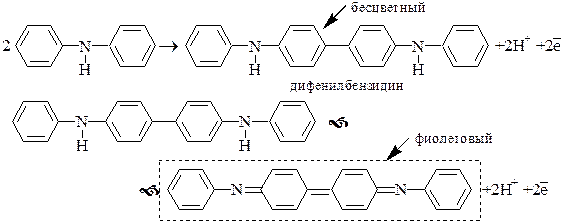
Дифениламин и его производные являются одноцветными индикаторами. Их окисленная форма фиолетовая с различными оттенками в зависимости от заместителей, восстановленная – бесцветна. В процессе восстановления индикаторов из группы дифениламина участвуют протоны, поэтому величина электродного потенциала у этих веществ зависит от рН (рядом с формулами приведены значения E0 для рН 0).
Ферроин – это комплекс катионов железа с фенантролином.
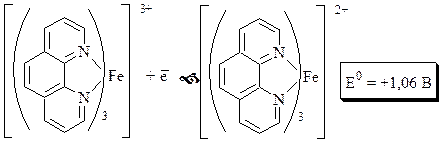
Ферроин - двухцветный индикатор, но интенсивность окраски у различных его форм неодинакова. Восстановленная форма имеет интенсивную красно-оранжевую окраску, окисленная – бледно-голубую. В отличие от дифениламина его окислительно-восстановительные свойства в значительно меньшей степени зависят от рН.
Изменение окраски окислительно-восстановительных индикаторов происходит в некотором интервале определяемого с их помощью свойства системы, в данном случае электродного потенциала. Рассмотрим двухцветный индикатор, в полуреакцию с участием которого не входят протоны (либо их концентрация равна 1 моль/л).
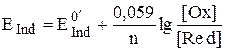
Будем считать, что для того, чтобы изменение окраски было заметным, концентрация одной окрашенной формы должна стать в 10 раз больше, чем другой. Таким образом, переход окраски индикатора будет происходить в диапазоне
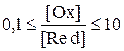
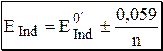
Так, изменение окраски одноэлектронного индикатора будет происходить в пределах 120 мВ, двухэлектронного – 60 мВ.
Полученная формула описывает идеальный случай, когда окраски различных форм индикатора имеют одинаковую интенсивность и одинаково воспринимаются глазом. В действительности это обычно не так. Например, переход окраски ферроина в 1 М H2SO4 происходит в интервале 1,08 – 1,20 В, при том, что величина формального потенциала данного индикатора при этих условиях равна 1,06 В. Из-за того что восстановленная форма ферроина имеет значительно более интенсивную окраску, чем окисленная, начало перехода окраски визуально обнаруживается лишь тогда, когда концентрация окисленной формы более чем в 2 раза превысит концентрацию восстановленной формы.
В случае одноцветного индикатора, так же, как и в случае одноцветного кислотно-основного индикатора переход окраски зависит ещё и от общей концентрации индикатора в растворе.
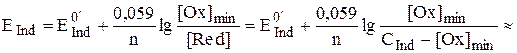
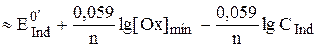
Как и при других видах титрования конечная точка титрования, обнаруживаемая с помощью индикатора, может в той или иной степени не совпадать с точкой эквивалентности, что приводит к возникновению систематической индикаторной погрешности. Принцип оценки величины такой погрешности при окислительно-восстановительном титровании заключается в сравнении потенциалов в точке эквивалентности и в конечной точке титрования и дальнейшем определении величины f для конечной точки титрования.
Пример 17.1. Определить вид и рассчитать величину систематической индикаторной погрешности титрования 1,0×10-2 М Fe2+1,0×10-2 М раствором Ce4+в 1 М H2SO4, если конечную точку титрования обнаруживают с помощью а) дифениламина; б) ферроина.
Как мы уже определили при построении кривой титрования, в точке эквивалентности величина электродного потенциала системы будет равна +1,06 В. Будем считать, что в конечной точке титрования с дифениламином Е » +0,75 В, а с ферроином » +1,15 В. Следовательно, титрование с первым индикатором будет приводить к появлению отрицательной систематической индикаторной погрешности, а со вторым - положительной.
При Е = +0,75 В величина степени оттитрованности составит
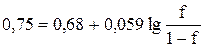
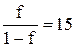 , f = 0,94
, f = 0,94
Следовательно, величина систематической индикаторной погрешности будет равна –6,0%.
Если титрование заканчивается при Е =+0,70 В величина систематической индикаторной погрешности равна –31%, а если при +0,80 В - -1,0%.
При E = +1,15 В значение степени оттитрованности будет равно
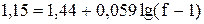
f – 1 » 1×10-5
Таким образом, величина систематической индикаторной погрешности составит всего лишь +1×10-3%.
| <== предыдущая страница | | | следующая страница ==> |
| Кривые титрования. Кривая титрования в окислительно-восстановительном титровании представляет собой зависимость электродного потенциала системы от степени оттитрованности | | | Иодометрическое титрование |
Дата добавления: 2014-10-10; просмотров: 769; Нарушение авторских прав

Мы поможем в написании ваших работ!