
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Кривые титрования. Кривая титрования в окислительно-восстановительном титровании представляет собой зависимость электродного потенциала системы от степени оттитрованности
Кривая титрования в окислительно-восстановительном титровании представляет собой зависимость электродного потенциала системы от степени оттитрованности.
Пусть при титровании протекает химическая реакция
n2Red1 + n1Ox2 › n2Ox1 + n1Red2,
в которой Red1 – определяемое вещество, Ox2 – титрант.
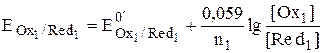
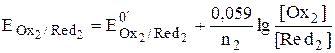
В процессе титрования после добавления каждой очередной порции титранта в системе будет устанавливаться химическое равновесие, при котором 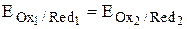 . Величина электродного потенциала, которая устанавливается при таком равновесии, называется электродным потенциалом системы. При построении кривой титрования величину потенциала удобнее рассчитывать для того вещества, которое в данных условиях находится в избытке: до точки эквивалентности – это титруемое вещество, после точки эквивалентности – титрант.
. Величина электродного потенциала, которая устанавливается при таком равновесии, называется электродным потенциалом системы. При построении кривой титрования величину потенциала удобнее рассчитывать для того вещества, которое в данных условиях находится в избытке: до точки эквивалентности – это титруемое вещество, после точки эквивалентности – титрант.
Рассмотрим титрование 1,0×10-2 М Fe2+ 1,0×10-2 М раствором Ce4+, протекающее в 1 М H2SO4. Величины формальных потенциалов для Fe3+/Fe2+ и Ce4+/Ce3+ в данных условиях равны, соответственно +0,68 и + 1,44 В. Формулы для расчёта электродного потенциала системы в различных точках кривой титрования и рассчитанные по ним значения E приведены в табл. 17.1. Сама кривая титрования показана на рис. 17.1.
Табл. 17.1
Расчёты для построения кривой титрования 1,0×10-2 М Fe2+
1,0×10-2 М раствором Ce2+в 1 М H2SO4
| f | Расчётная формула | E, В |
| 0,10 | 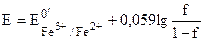
| 0,62 |
| 0,50 | аналогично | 0,68 |
| 0,90 | аналогично | 0,74 |
| 0,99 | аналогично | 0,80 |
| 0,999 | аналогично | 0,86 |
| 1,00 | 
| 1,06 |
| 1,001 | 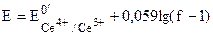
| 1,26 |
| 1,01 | аналогично | 1,32 |
| 1,10 | аналогично | 1,38 |
| 1,50 | аналогично | 1,42 |
Из-за того, что концентрация окисленной формы определяемого вещества, если само оно является восстановителем, либо, наоборот, его восстановленной формы, если определяемое вещество – окислитель, в нулевой точке неизвестна, кривые окислительно-восстановительного титрования начинают строить с некоторого ненулевого значения f.
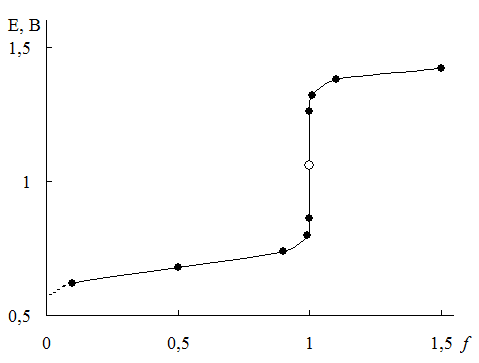
Рис. 17.1. Кривая титрования 1,0×10-2 М Fe2+1,0×10-2 М Ce4+в 1 М H2SO4
В точке эквивалентности обе полуреакции с точки зрения их использования для расчёта величины электродного потенциала системы оказываются равноценными.
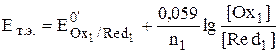
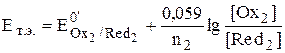
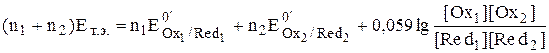
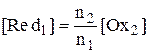 ,
,
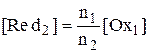
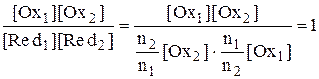
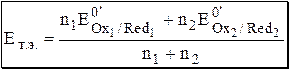
Для рассматриваемого случая n1 = n2 = 1, поэтому
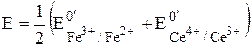
Точка эквивалентности в рассматриваемом случае титрования находится в середине скачка титрования. Если число электронов, принимающих участие в двух полуреакциях, неодинаково, то величина потенциала системы в точке эквивалентности будет ближе к величине стандартного потенциала той полуреакции, в которой участвует больше электронов.
Полученная нами формула для расчёта Ет.э. не является универсальной и подходит лишь для тех случаев, когда в полуреакциях не принимают участие ионы H3O+ (либо их концентрация считается равной 1 моль/л), и не изменяется число частиц, являющихся окислителем или восстановителем.
Величина скачка титрования в окислительно-восстановительном титровании зависит от разности стандартных (формальных) потенциалов окислителя и восстановителя. Все факторы, влияющие на величину этих потенциалов, оказывают влияние и на величину скачка титрования. Если в реакции, протекающей при титровании, принимают участие протоны, то ход кривой титрования зависит от рН. В отличие от других видов титрования внешний вид кривой окислительного титрования практически не зависит от концентрации титруемого вещества и титранта, если только при титровании не изменяется число частиц, как при титровании дихроматом, а также если раствор не разбавлен настолько, что протекающую реакцию уже нельзя считать количественной.
| <== предыдущая страница | | | следующая страница ==> |
| Общая характеристика и классификация | | | Способы обнаружения конечной точки титрования. Окислительно-восстановительные индикаторы |
Дата добавления: 2014-10-10; просмотров: 447; Нарушение авторских прав

Мы поможем в написании ваших работ!