
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Способы обнаружения конечной точки титрования. Металлоиндикаторы
Для обнаружения конечной точки комплексонометрического титрования могут быть использованы визуальные или инструментальные (фотометрия, ионоселективные электроды и др.) методы.
Визуальное обнаружение конечной точки титрования чаще всего проводят с помощью металлоиндикаторов – веществ, изменяющих окраску (или флуоресценцию) в зависимости от концентрации катионов металла в растворе.

Некоторые металлоиндикаторы, относящиеся ко второй группе, образуют с катионами металлов флуоресцирующие внутрикомплексные соединения. Такие индикаторы называются металлофлуоресцентными.
Эриохром чёрный Т (хромоген чёрный ЕТ 00) - металлохромный индикатор из группы азокрасителей. Представляет собой трёхосновную кислоту, однако, на окраску влияет ионизация только OH-групп, но не SO3H-группы. Образует окрашенные внутрикомплексные соединения с катионами более 20 металлов.
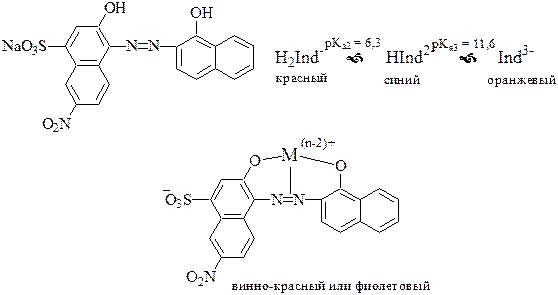
Эриохром чёрный Т используют для обнаружения конечной точки комплексонометрического титрования катионов различных металлов в щелочных растворах (как правило, при рН 8-10).
В растворах (особенно щелочных) эриохром чёрный Т быстро окисляется кислородом воздуха, поэтому его применяют в виде твёрдого вещества. Поскольку индикатор интенсивно окрашен, его разбавляют NaCl (1:200) и затем приготовленную смесь вносят в титруемый раствор.
Пирокатехиновый фиолетовый – металлоиндикатор из группы сульфофталеиновых красителей. Представляет собой четырёхосновную кислоту. Комплексы с металлами обычно окрашены в синий цвет.
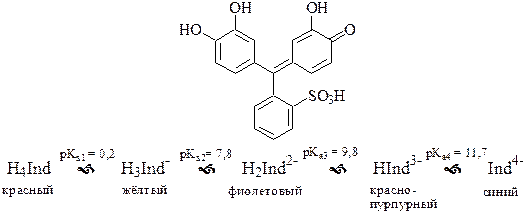
Может быть использован для обнаружения конечной точки комплексонометрического титрования при различном значении рН, например, Bi3+ при рН 2-3, Cu2+ - рН 5-6 (ацетатный буферный раствор), Mg2+, Ni2+, Zn2+ - рН 9-10 (аммиачный буферный раствор).
Ксиленоловый оранжевый - индикатор из группы сульфофталеиновых красителей. Представляет собой шестиосновную кислоту.
Формы H6Ind – H3Ind3- окрашены в жёлтый цвет, остальные – в красный. Комплексы с катионами металлов имеют красную или пурпурную окраску. Так же как и пирокатехиновый фиолетовый, ксиленоловый оранжевый может быть использован для обнаружения конечной точки комплексонометрического титрования при различных значениях рН, например, Bi3+ - при рН 1-3, Pb2+ - при рН 5-6 (ацетатный буферный раствор), Ca2+ и Mg2+ - при рН 10.
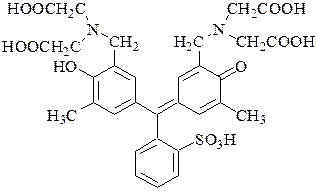
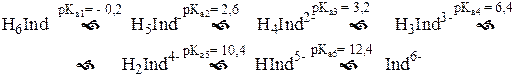
Мурексид – это аммониевая соль 5,5’-нитрилодибарбитуровой кислоты
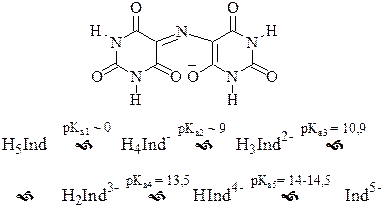
Неионизированная кислота окрашена в жёлтый цвет, моноанион – фиолетовый, дианион – голубой.
Мурексид может образовывать протонированные комплексы разного состава, имеющие различную окраску. Например, комплекс CaH4Ind+ (lgb = 2,6) окрашен в жёлто-оранжевый цвет, CaH3Ind - (lgb = 3,6) – в красно-оранжевый, CaH2Ind- + (lgb = 5,0) – в красный.
Мурексид может играть роль металлохромного индикатора при различных значениях рН. Например, комплексонометрическое определение ионов Cu2+ с данным индикатором проводят при рН 4 (ацетатный буферный раствор), Ni2+ - при рН 9-11 (аммиачный буферный раствор), Ca2+ - при рН > 12. В водных растворах мурексид быстро разрушается, поэтому его применяют в виде смеси с NaCl (1:100).
Сущность обнаружения конечной точки комплексонометрического титрования с помощью металлохромного индикатора заключается в следующем. При добавлении индикатора к исходному раствору титруемого катиона металла образуется окрашенный растворимый комплекс. В процессе титрования данного раствора ЭДТА в точке эквивалентности или вблизи неё комплекс катиона металла с индикатором разрушается, и окраска раствора становится такой же, как и у раствора индикатора при данном значении рН.
Для успешного обнаружения конечной точки титрования с помощью металлохромного индикатора необходимо, чтобы:
· комплекс MInd был достаточно устойчив, и его образование происходило бы уже при малых концентрациях индикатора;
· устойчивость комплекса MInd была бы меньше устойчивости комплекса данного катиона металла с ЭДТА и такой, чтобы разрушение комплекса MInd происходило в пределах скачка титрования;
· комплекс MInd был кинетически лабильным, и его разрушение при взаимодействии с ЭДТА происходило быстро;
· окраска комплекса MInd отличалась от окраски свободного индикатора при данном значении рН.
Устойчивость комплексов катионов металлов с индикаторами, так же как и устойчивость комплексов с ЭДТА, удобно описывать с помощью условных констант образования:
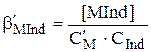
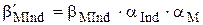
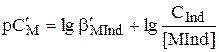
Если принять, что изменение окраски будет заметно, когда концентрация одной из окрашенных форм станет в 10 раз больше, чем другой, то интервал перехода окраски металлохромного индикатора должен находиться в следующем диапазоне величин 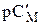 :
:
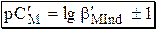
При титровании катионов Ca2+ или Mg2+, не образующих устойчивых аммиачных или гидроксокомплексов, можно считать, что
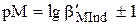
Пример 15.1. Определить возможность использования индикатора эриохрома чёрного Т для обнаружения конечной точки титрования 5,0×10-2 М Ca2+ и Mg2+ 5,0×10-2 М раствором ЭДТА при рН 9,50.
При рН 9,50 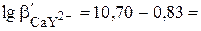 9,87. В точке эквивалентности -
9,87. В точке эквивалентности -
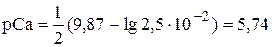
В нижней и верхней границах скачка титрования:
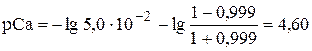
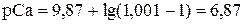
Величины Ka2 и Ka3 индикатора равны, соответственно, 5,0×10-7 и 2,5×10-12. Следовательно, значение a(Ind3-) при рН 9,50 ([H3O+] = 3,2×10-10 моль/л) будет равно:
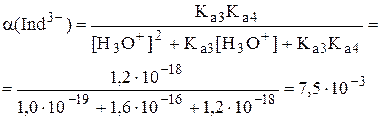
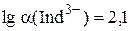
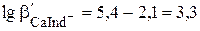
Переход окраски будет происходить в диапазоне pCa 2,3 – 4,3. Таким образом, при попытке обнаружить конечную точку титрования с помощью эриохрома чёрного Т раствор окажется недотитрованным.
При рН 9,50 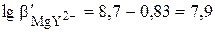 . В точке эквивалентности величина pMg будет равна 4,75. Для комплекса иона Mg2+
. В точке эквивалентности величина pMg будет равна 4,75. Для комплекса иона Mg2+ 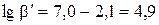 . Точка эквивалентности будет находиться почти в середине интервала перехода индикатора (3,9 – 5,9). Следовательно, эриохром чёрный может быть использован для обнаружения конечной точки комплексонометрического титрования 5×10-2 М Mg2+.
. Точка эквивалентности будет находиться почти в середине интервала перехода индикатора (3,9 – 5,9). Следовательно, эриохром чёрный может быть использован для обнаружения конечной точки комплексонометрического титрования 5×10-2 М Mg2+.
| <== предыдущая страница | | | следующая страница ==> |
| Кривые титрования | | | Индикаторные погрешности |
Дата добавления: 2014-10-10; просмотров: 763; Нарушение авторских прав

Мы поможем в написании ваших работ!