
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Расчёты для построения кривой титрования
0,10 М NaCl 0,10 М AgNO3
| f | Расчётная формула | pCl | pAg |
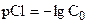
| 1,00 | - | |
| 0,100 | 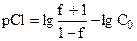
| 1,09 | 8,65 |
| 0,500 | аналогично | 1,48 | 8,26 |
| 0,900 | аналогично | 2,28 | 7,46 |
| 0,990 | аналогично | 3,30 | 6,44 |
| 0,999 | аналогично | 4,3 | 5,4 |
| 1,000 | 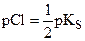
| 4,87 | 4,87 |
| 1,001 | 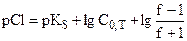
| 5,4 | 4,3 |
| 1,01 | аналогично | 6,44 | 3,30 |
| 1,10 | аналогично | 7,42 | 2,32 |
| 1,50 | аналогично | 8,04 | 1,70 |
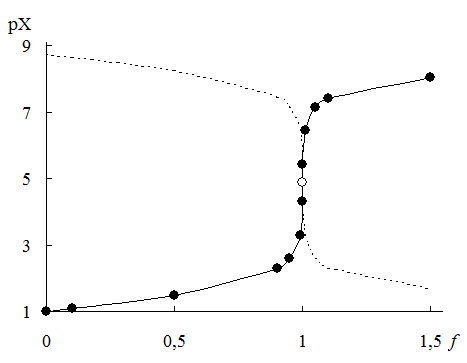
Рис. 16.1. Кривая титрования 0,10 М NaСl 0,10 M AgNO3
Пунктиром показано изменение pAg в процессе титрования
Величина скачка титрования в аргентометрии зависит от исходной концентрации титруемого аниона и титранта и растворимости образующегося осадка (рис. 16.2)
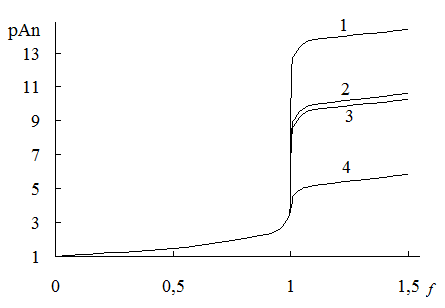
Рис. 16.2. Кривые титрования 0,1 М растворов анионов 0,1 М AgNO3
1 – иодид (pKS = 16,08); 2 – бромид (12,28); 3 – тиоцианат (11,96); 4 – иодат (7,52).
Факторы, способствующие увеличению растворимости (нагревание, увеличение ионной силы), приводят к уменьшению величины скачка титрования.
| <== предыдущая страница | | | следующая страница ==> |
| Общая характеристика. Осадительное титрование - группа титриметрических методов анализа, основанных на реакциях образования малорастворимых соединений | | | Метод Мора |
Дата добавления: 2014-10-10; просмотров: 362; Нарушение авторских прав

Мы поможем в написании ваших работ!