
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Метод Мора
В данном методе в качестве индикатора для обнаружения конечной точки титрования используется хромат калия. Хромат калия в аргентометрии представляет собой осадительный индикатор.
Осадительными индикаторами называются вещества, выделяющиеся из раствора в виде осадка в хорошо заметной форме в точке эквивалентности или вблизи неё.
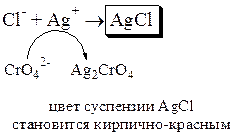
Величина произведения растворимости у Ag2CrO4 (KS = 1,1×10-12) меньше, чем у AgCl, но растворимость в воде больше (6,5×10-5 моль/л и 1,3×10-5 моль/л соответственно). При титровании 0,10 М NaCl 0,10 М раствором AgNO3 в точке эквивалентности pAg = 4,87 (табл. 16.1). Следовательно, pCrO4 = pKs(Ag2CrO4) – 2pAg = 2,2, 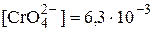 моль/л. Нижней (pAg = 5,4) и верхней (pAg = 4,3) границам скачка титрования соответствуют концентрации CrO42-, равные, соответственно, 1×10-1 и 4×10-4 моль/л. Практически обнаружение конечной точки титрования проводят при концентрациях дихромат-иона 0,005 – 0,01 моль/л. Для того чтобы учесть количество титранта, необходимое для образования минимального визуально обнаруживаемого количества Ag2CrO4, проводят контрольный опыт. В качестве модельного титруемого объекта при его выполнении берут суспензию CaCO3.
моль/л. Нижней (pAg = 5,4) и верхней (pAg = 4,3) границам скачка титрования соответствуют концентрации CrO42-, равные, соответственно, 1×10-1 и 4×10-4 моль/л. Практически обнаружение конечной точки титрования проводят при концентрациях дихромат-иона 0,005 – 0,01 моль/л. Для того чтобы учесть количество титранта, необходимое для образования минимального визуально обнаруживаемого количества Ag2CrO4, проводят контрольный опыт. В качестве модельного титруемого объекта при его выполнении берут суспензию CaCO3.
Метод Мора используется для определения хлорид- или бромид-ионов в нейтральных или слабощелочных растворах.
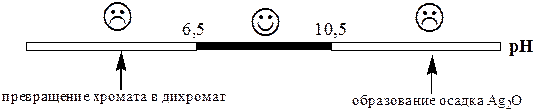
Метод Мора не используется для определения иодид- и тиоцианат ионов. Осадки AgI и AgSCN адсорбируют большое количество хромат- ионов, поэтому чёткое обнаружение конечной точки титрования становится невозможным. При использовании метода Мора в растворе не должны присутствовать катионы (например, Ba2+), образующие малорастворимые окрашенные хроматы.
| <== предыдущая страница | | | следующая страница ==> |
| Расчёты для построения кривой титрования | | | Метод Фольгарда |
Дата добавления: 2014-10-10; просмотров: 474; Нарушение авторских прав

Мы поможем в написании ваших работ!