
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Титранты и стандартные вещества. В качестве титрантов в иодометрическом титровании используют иод (трииодид) и тиосульфат натрия
В качестве титрантов в иодометрическом титровании используют иод (трииодид) и тиосульфат натрия.
Растворимость иода в воде при 20 °С составляет примерно 1,3×10-3 моль/л. В присутствии KI за счёт протекания реакции образования [I3]- растворимость иода заметно увеличивается
Содержание молекулярного иода в полученном растворе оказывается значительно меньшим по сравнению с [I3]-, поэтому такой раствор следовало бы называть раствором трииодида. Однако, поскольку I2 и [I3]- ведут себя в окислительно-восстановительных реакциях практически одинаково, раствор, полученный при растворении I2 в присутствии KI, традиционно называют раствором иода.
Стандартный раствор иода может быть первичным или вторичным. Образец иода, используемый для получения первичного стандартного раствора, подвергают дополнительной очистке. Очищаемый образец иода вначале растирают с KI (для удаления хлора и брома) и CaO (для удаления воды), а затем подвергают возгонке.
Если раствор иода готовится как вторичный стандартный раствор, то его необходимо подвергнуть стандартизации. В фармацевтической практике раствор иода обычно стандартизируют с помощью стандартного раствора Na2S2O3.
Основными процессами, ведущими к изменению концентрации [I3]- в стандартном растворе, являются улетучивание иода и окисление I- до I2 кислородом воздуха. Последний процесс ускоряется на свету и в присутствии катионов некоторых металлов. Из всего этого следует, что стандартный раствор иода следует хранить в прохладном и защищённом от света месте в сосудах тёмного стекла с притёртыми пробками. Корковые или резиновые пробки для укупорки сосудов использовать нельзя.
Для приготовления стандартного раствора тиосульфата натрия используют Na2S2O3×5H2O. Это вещество является неустойчивым. Оно легко подвергается выветриванию, взаимодействует в растворе с CO2, может окисляться кислородом воздуха и разлагаться тиобактериями
Na2S2O3 + CO2 + H2O ® NaHSO3 + S¯ + NaHCO3
2Na2S2O3 + O2 ® 2S¯ + 2Na2SO4
Стандартный раствор тиосульфата натрия является вторичным. Для его приготовления навеску Na2S2O3×5H2O растворяют в свежепрокипячённой воде. Для увеличения рН в раствор добавляют немного безводного Na2CO3. После приготовления раствор Na2S2O3 выдерживают несколько суток в закрытом сосуде в защищённом от света месте, а затем подвергают стандартизации. Стандартный раствор Na2S2O3 хранят в сосудах тёмного стекла с притёртыми пробками в защищённом от света месте. Для предотвращения взаимодействия данного вещества с CO2 сосуды защищают хлоркальциевыми трубками. Для того чтобы в растворе не развивались тиобактерии, к нему можно добавить небольшое количество антисептика: фенола, бензоата натрия, хлороформа и др.
Для стандартизации растворов Na2S2O3 используют K2Cr2O7 либо стандартный раствор иода. Реакции Na2S2O3 с K2Cr2O7 и другими сильными окислителями протекают нестехиометрично, поэтому стандартизацию тиосульфата натрия проводят способом титрования заместителя:
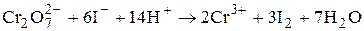
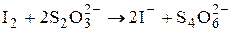
Первую из данных реакций проводят в кислой среде (H2SO4) и в присутствии 3-4-кратного избытка KI. Иодид-ионов должно хватить не только на реакцию с дихроматом калия, но и на растворение образующегося иода. Реакция взаимодействия K2Cr2O7 и KI требует некоторого времени, поэтому после смешивания реагентов колбу закрывают стеклом и оставляют в защищённом от света месте на 5-10 минут. После этого раствор разбавляют водой (для уменьшения кислотности) и титруют выделившийся иод стандартизируемым раствором Na2S2O3.
Реакцию взаимодействия иода с тиосульфатом натрия проводят при рН 0 – 7. В щелочной среде иод превращается в иодид и гипоиодит, который окисляет тиосульфат не до тетратионата, как I2, а до сульфата.
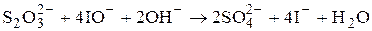
Если титрование иода тиосульфатом натрия проводить в щелочной среде, то результаты определения концентрации Na2S2O3 в растворе окажутся завышенными. Верхняя граница значений рН, допустимых для проведения реакции иода с тиосульфатом, зависит от концентрации взаимодействующих веществ. Для 1×10-1 М растворов рН должен быть меньше 7,6, а для 1×10-3 М – меньше 5.
В сильнокислой среде тиосульфат разрушается
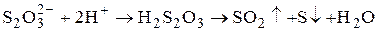
Эта реакция протекает более медленно, чем реакция с иодом, поэтому титрование иода тиосульфатом натрия можно проводить и при достаточно высокой кислотности раствора, если раствор тиосульфата прибавлять по каплям и реакционную смесь тщательно перемешивать.
| <== предыдущая страница | | | следующая страница ==> |
| Иодометрическое титрование | | | Обнаружение конечной точки титрования |
Дата добавления: 2014-10-10; просмотров: 390; Нарушение авторских прав

Мы поможем в написании ваших работ!