
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Обнаружение конечной точки титрования
Конечную точку титрования в иодометрии обнаруживают по собственной окраске иода, по исчезновению или появлению окраски иодкрахмального комплекса либо инструментальными методами.
Предел обнаружения иода по собственной жёлто-оранжевой окраске равен приблизительно 5×10-5 моль/л 1/2I2. Конечную точку титрования возможно обнаруживать при работе с 0,02 М и более концентрированными растворами. Предел обнаружения иода можно понизить, если к раствору прибавить немного неполярного органического растворителя (CCl4, CHCl3 и т.п.), экстрагирующего иод.
Специфическим индикатором, используемым в иодометрическом титровании, является крахмал, образующий с иодом соединение синего цвета. Предел обнаружения иода по реакции с крахмалом в 25-50 раз ниже, чем по собственной окраске. Появление синей окраски обусловлено взаимодействием иода с амилозой. Реакция между этими веществами требует обязательного присутствия иодид-ионов. Полиодиды (главным образом [I5]-), образующиеся при взаимодействии I2 и I-, проникают внутрь спирали амилозы, образуя окрашенный продукт. Иод может взаимодействовать и с амилопектином, но продукт реакции окрашен в красный цвет. Окрашенные соединения образуются также при взаимодействии иода с поливиниловым спиртом, циклодекстринами и другими веществами, в структуре которых имеются каналы или полости

Чувствительность реакции иода с крахмалом уменьшается при нагревании раствора. Вследствие гидролиза крахмал нельзя применять для обнаружения иода в сильнокислых растворах.
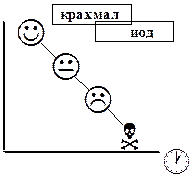
|
Крахмал следует добавлять к титруемому раствору с таким расчётом, чтобы время контакта его с иодом было минимальным, поскольку это может привести к нежелательным последствиям: окислению крахмала иодом, коагуляции крахмала в присутствии иода, выпадению осадка иодкрахмального комплекса. Поэтому если в титруемом растворе содержится иод (титрование избытка иода при обратном титровании или титрование иода, образовавшегося при окислении KI), то крахмал следует добавлять незадолго до достижения конечной точки титрования, когда окраска раствора станет бледно-жёлтой («соломенно-жёлтой»). Титрование в данном случае заканчивают при исчезновении синей окраски иодкрахмального комплекса. В случае прямого титрования раствором иода крахмал добавляют в начале титрования. О наступлении конечной точки титрования свидетельствует появление синей окраски соединения крахмала с иодом.
Способы иодометрического титрования и его применение в фармацевтическом анализе
Прямое титрование раствором иода используется для определения веществ, взаимодействие которых с иодом протекает стехиометрично и быстро. Таким образом можно определять, соединения As(III), Sb(V), SO2 и другие сильные восстановители.
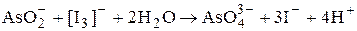 (при рН 7-8)
(при рН 7-8)
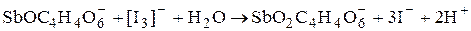
(в присутствии избытка тартрата)
Из органических веществ прямым иодометрическим титрованием может быть определена, например, аскорбиновая кислота.
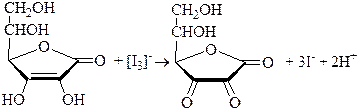
Определение аскорбиновой кислоты проводят в слабокислой, нейтральной и слабощелочной среде (в щелочной окисление протекает более глубоко – с разрывом лактонного цикла)
Реакция взаимодействия иода с SO2
I2 + SO2 + 2H2O ® 2HI + H2SO4
протекает только в присутствии воды. Методика определения небольших количеств гигроскопической и кристаллизационной воды, основанная на данной реакции, была предложена в 1935 году Карлом Фишером. Реактив Карла Фишера представляет собой смесь растворов I2 в безводном метаноле и SO2 в безводном пиридине (либо 2 отдельных раствора). Вместо метанола могут быть использованы диметилформамид, пропанол, трет-бутанол и другие высшие спирты. В качестве оснόвного компонента, необходимого для связывания выделяющихся протонов, можно брать не только пиридин, но и этаноламин, имидазол, ацетат натрия.
Суммарное уравнение реакции взаимодействия реактива Карла Фишера с водой имеет следующий вид
H2O + I2 + SO2 + CH3OH + 3B ® [BH]SO4CH3 + 2[BH]I
основание
Реактив Карла Фишера готовится как вторичный стандартный раствор. Его стандартизацию проводят по навеске воды, раствору воды в метаноле, некоторым кристаллогидратам.
Реактив Карла Фишера имеет коричневую окраску. При взаимодействии с водой она переходит в бледно-жёлтую. Конечную точку титрования можно обнаружить по появлению коричневой окраски при добавлении лишней капли титранта, а также потенциометрически либо амперометрически.
Реакции окисления многих, особенно органических, веществ иодом протекают медленно, и могут быть применены лишь для обратного титрования. Обратное иодометрическое титрование используется для определения различных альдегидов, например, формальдегида, глюкозы; веществ, вступающих в иодоформную реакцию, например, ацетона; гидразидов, например, противотуберкулёзного лекарственного вещества изониазида; семикарбазидов, например, фурацилина; тиоэфиров, например, аминокислоты метионина; а также пенициллина, антипирина, кофеина и других веществ. Иод является достаточно слабым окислителем, поэтому во многих случаях окисление определяемого вещества проводится в щелочной среде и окислителем является, собственно, не иод, а гипоиодит. После завершения реакции раствор подкисляют серной кислотой и затем титруют избыток иода стандартным раствором Na2S2O3.
RCHO + I2 + 3NaOH ® RCOONa + 2NaI + 2H2O
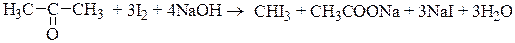
Иодометрическое титрование может быть основано не на обычном окислении иодом, а на других процессах. Например, иодометрическое определение антипирина основано на реакции электрофильного замещения и проводится в слабокислой среде (ацетатный буферный раствор).
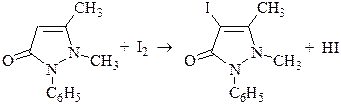
Титрование иода, образовавшегося в результате взаимодействия вещества с KI, используется для определения различных окислителей, например, соединений, содержащих активный хлор, Cu2+, Fe3+, Cr(VI), MnO4-, H2O2 и органических пероксидов и др., а также для определения избытка титранта-окислителя в броматометрии, дихроматометрии, цериметрии и в других методах окислительно-восстановительного титрования. Окисление иодид-ионов до иода протекает медленно. По этой причине прямое титрование перечисленных веществ раствором KI невозможно и приходится прибегать к титрованию заместителя. Более подробно среди многочисленных случаев такого иодометрического титрования мы рассмотрим определение веществ, содержащих активный хлор, а также ионов Cu2+.
Активным хлором называется такой хлор, который выделяется в свободном виде при взаимодействии вещества с хлороводородной кислотой. Массовая доля (%) активного хлора в веществе равна массе Cl2, который образуется при взаимодействии 100 г вещества с избытком HCl. Например, при взаимодействии 100 г Сa(ClO)2 с избытком HCl
Сa(ClO)2 + 4HCl ® 2Cl2 + CaCl2 + 2H2O
выделяется 99,2 г Сl2, поэтому массовая доля активного хлора в химически чистом гипохлорите кальция составляет 99,2%.
На практике активный хлор определяют как массу хлора, который способен выделить из раствора KI столько же иода, что и 100 г данного вещества. Выделившийся иод затем титруют стандартным раствором тиосульфата натрия. Титр 0,1000 М Na2S2O3 по активному хлору равен 3,546×10-3 г/мл. Стандартизируют по содержанию активного хлора такие вещества как хлорная известь (содержание активного хлора не менее 32%), хлорамин Б (25-29%), пантоцид (не менее 50%) и др.
Определение ионов Cu2+ основано на реакции
2Cu2+ + 4I- ® 2CuI¯ + I2
Величина стандартного электродного потенциала для системы Cu2+/CuI¯ равна +0,86 В, поэтому данная окислительно-восстановительная реакция возможна. Выделившийся иод титруют стандартным раствором Na2S2O3. Определение проводят при рН 2-4 для предотвращения образования гидроксокомплексов меди и в присутствии избытка I-.
Иодометрическое титрование используется не только для определения меди в различных объектах, но и для косвенного определения органических веществ, взаимодействующих с ионами Cu2+. Например, так можно определять никотиновую кислоту, образующую с ионами меди малорастворимую комплексную соль.
| <== предыдущая страница | | | следующая страница ==> |
| Титранты и стандартные вещества. В качестве титрантов в иодометрическом титровании используют иод (трииодид) и тиосульфат натрия | | | Хлориодометрическое титрование |
Дата добавления: 2014-10-10; просмотров: 581; Нарушение авторских прав

Мы поможем в написании ваших работ!