
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Хлориодометрическое титрование
Хлориодометрическое титрование – титриметрический метод анализа, в котором в качестве титранта используется монохлорид иода.
В зависимости от условий монохлорид иода может восстанавливаться до I- или I2:
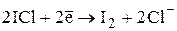 E0 = +1,19В
E0 = +1,19В
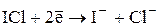 E0 = +0,79В
E0 = +0,79В
В фармацевтическом анализе обычно используется такое титрование, при котором продуктом восстановления ICl является I-.
Хлориодометрическое титрование, в целом, похоже на иодометрическое. Хлорид иода является более сильным окислителем, чем иод и более сильным электрофилом, что позволяет использовать его в качестве реагента в реакциях иодирования органических соединений. Растворы ICl более устойчивы, чем растворы [I3]-.
Монохлорид иода представляет собой ионное соединение и находится в растворе HCl в виде комплекса I+[ICl2]-.
Стандартный раствор ICl является вторичным. Это вещество получают окислением иодида калия иодатом калия в присутствии HCl:
2 KI + KIО3 + 6 НCl ® 3 ICl + 3KCl + 3Н2О
Для того чтобы убедиться, что в растворе не осталось избытка иодида или иодата, поступают следующим образом
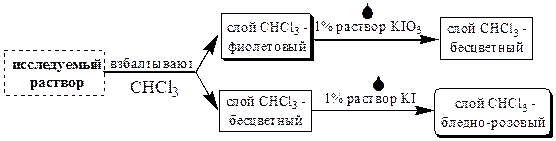
После проведения данных операций смеси дают некоторое время отстояться и затем водную фазу переносят в мерную колбу и доводят водой до метки. Растворы ICl при условии того, что они содержат достаточное количество HCl, довольно устойчивы. Их хранят в сосудах тёмного стекла в защищённом от света месте.
Стандартизацию раствора ICl обычно проводят способом иодометрического титрования. К стандартизируемому раствору прибавляют избыток KI и оставляют в защищённом от света месте на 15 минут.
ICl + KI ® I2 + KCl
Выделившийся иод титруют стандартным раствором Na2S2O3.
Конечную точку хлориодометрического титрования обнаруживают с помощью электрохимических методов (потенциометрия, амперометрия) либо визуально:
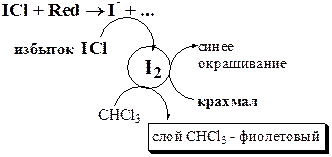
Хлориодометрическое титрование проводится в кислой, нейтральной или слабощелочной среде (но не щелочной или сильнощелочной из-за превращения I+ в IO-) и может быть прямым или обратным. В случае прямого титрования определяемое вещество титруют стандартным раствором ICl. Таким образом можно определять, например, аскорбиновую кислоту, а также As(III), Sb(III), Sn(II) и т.д.
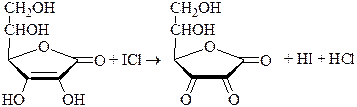
При обратном титровании к определяемому веществу добавляют точное количество взятого в избытке стандартного раствора ICl. После протекания реакции (если необходимо реакционную смесь нагревают) избыток ICl восстанавливают иодидом калия до I2, который титруют стандартным раствором Na2S2O3. Таким образом можно, определять различные органические вещества, способные вступать в реакцию SE с I+: фенолы, сульфаниламиды, производные п-аминобензойной кислоты, гетероциклические соединения (этакридина лактат) и т.п.
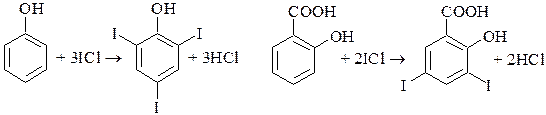
Обратное хлориодометрическое титрование используется также для определения органических веществ, в молекулах которых имеются кратные связи, и которые способны вступать в реакцию AE. Подобная реакция положена, например, в основу определения иодного числа. Иодным числом называют массу иода (г), присоединяющегося к 100 г органического вещества. Иодное число характеризует степень ненасыщенности органического соединения и используется для качественной характеристики различных жиров и масел.
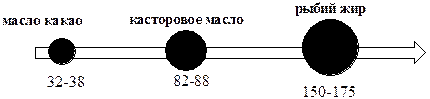
Определение иодного числа проводят следующим образом:
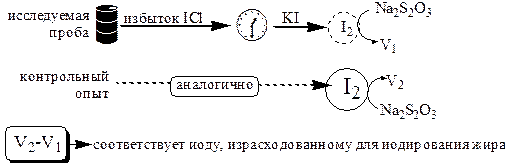
18.3. Иодатометрическое титрование
Иодатометрическое титрование - титриметрический метод анализа, в котором в качестве титранта используется KIO3.
В зависимости от условий проведения титрования иодат может восстанавливаться до различных продуктов: в кислой среде - до иодида, в 3 – 9 М HCl - до монохлорида иода:
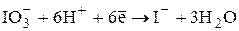 E0 = +1,08 В
E0 = +1,08 В
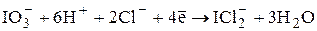 E0 = +1,23 В
E0 = +1,23 В
Обратите внимание, что факторы эквивалентности KIO3 в первой и второй реакциях различны. «По умолчанию», согласно Государственной фармакопее СССР, величина fэкв KIO3 при приготовлении его стандартного раствора принимается равной 1/6. Если иодатометрическое определение основано на второй полуреакции, то эта величина утрачивает свой смысл и лишь усложняет расчёты.
Иодат калия обладает всеми свойствами первичного стандартного вещества, поэтому стандартные растворы этого вещества можно готовить по точной навеске KIO3. При необходимости стандартизацию растворов проводят иодометрически. Вначале проводят реакцию
KIO3 + 5KI + 3H2SO4 ® 3I2 + 3K2SO4 + 3H2O
Затем выделившийся иод титруют стандартным раствором Na2S2O3.
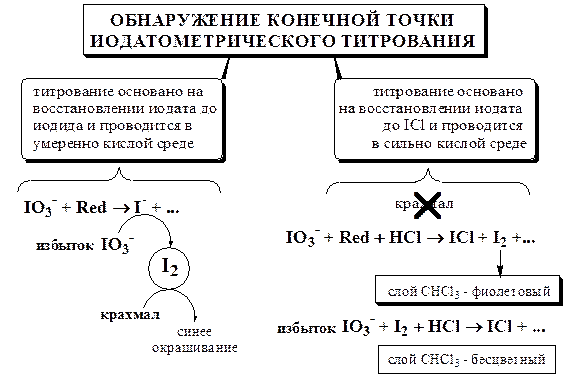
В качестве примера использования иодатометрического титрования в фармацевтическом анализе рассмотрим определение аскорбиновой кислоты и веществ, в молекуле которых содержится остаток гидразина.
Иодатометрическое определение аскорбиновой кислоты похоже на её хлориодометрическое определение. Оно проводится в умеренно кислой среде и сопровождается восстановлением иодата до иодида. Конечную точку титрования обнаруживают с помощью крахмала.
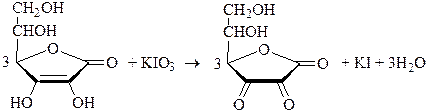
Иодатометрическое определение гидразина и его производных, а также соединений Sb(+3), As(+3), Tl(+1) и т.д. проводится при больших концентрациях HCl и сопровождается восстановлением титранта до монохлорида иода (или, точнее, до 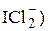 . Например, определение гидразина основано на следующей реакции
. Например, определение гидразина основано на следующей реакции
N2H4 + KIO3 + 2HCl ® ICl + N2 + KCl + 3H2O
Конечную точку титрования при таких определениях обнаруживают по обесцвечиванию хлороформного слоя.
| <== предыдущая страница | | | следующая страница ==> |
| Обнаружение конечной точки титрования | | | Броматометрическое титрование |
Дата добавления: 2014-10-10; просмотров: 621; Нарушение авторских прав

Мы поможем в написании ваших работ!