
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
АНТИОКСИДАНТЫ НЕФЕРМЕНТАТИВНОЙ ПРИРОДЫ
Ферментативные антиоксиданты обеспечивают преимущественно внутриклеточную защиту от свободнорадикальных повреждений, в плазме крови, лимфе, межтканевой жидкости и других средах их содержание незначительно. Вместе с тем, как уже ранее было отмечено, во всех водных или липидных фазах организма свободнорадикальные процессы могут протекать весьма интенсивно, защиту организма в этом случае обеспечивают различные вещества способные нейтрализовывать свободные радикалы (ингибиторы, перехватчики, или ловушки свободных радикалов), либо устранять из свободнорадикальных процессов их основной катализатор - ионы двухвалентного железа (хелаторы ионов металлов переменной валентности). В организме имеется множество веществ, обладающих антирадикальной активностью, но, пожалуй, основную роль играют соединения, содержащие енольные или SH- группы.
Ингибиторы свободных радикалов – это антиоксидантные соединения, имеющие легкоотдаваемый подвижный атом водорода, связь которого в структуре ингибитора (In-H) слабее (40-70 ккал/моль), чем связь R-H в молекуле полиеновой жирной кислоты (70-80 ккал/моль). Поскольку разрыв связи в молекуле антиоксиданта требует меньше энергии, ингибиторы успешно конкурируют с субстратами в реакциях со свободными радикалами:
R-H + In-H + ‘R* R-H + In* + ‘R-H
R-H + In-H + R-OO* R-H + In* + ROOH
R-H + In-H + R-O* R-H + In* + ROH
Основную роль в этих реакциях играет взаимодействие ингибитора со свободными радикалами ненасыщенных жирных кислот, однако это не приводит к исчезновению свободных валентностей в системе, так как появляется свободный радикал ингибитора – In*, взаимодействие радикала ингибитора с новой молекулой окисляемого субстрата принципиально возможно:
In* + R-HIn-H + R*,
но, учитывая малую активность радикала ингибитора, более вероятным является его взаимодействие с другими свободными радикалами:
In* + RO* In-O-R
In* + In* In-In
Первая из этих реакций представляет особый интерес, поскольку приводит к обрыву еще одной цепи той же молекулой ингибитора, т.е. свободные радикалы ингибитора могут проявлять антиоксидантные свойства.
В организме человека и животных действует система естественных биоантиоксидантов ингибиторов свободных радикалов – токоферолы, убихинон, цистеин, метионин и ряд других соединений.
Витамин Е – α-токоферол.Токоферолы синтезируются растениями и содержатся преимущественно в растительных маслах. Токоферолы являются обязательными компонентами пищи, так как в организме человека они не синтезируются. Существует несколько изомерных форм токоферолов, но в наибольших количествах в органах человека содержится α-токоферол (α-ТФ). Антирадикальная активность α-ТФ обусловлена наличием в его структуре гидроксильной группы –ОН, присоединенной к ароматическому ядру и экранированной двумя метильными группами. Благодаря наличию в структуре ароматического кольца обобщенной системы π-электронов происходит смещение отрицательного заряда на кислород, результатом чего становится возможным достаточно легкий отрыв атома водорода в гидроксильной группе -ОН с образованием радикальной формы –О* альфа-токоферола.
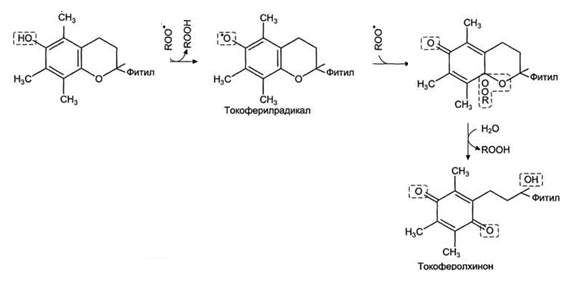
Рис.5. Механизм антиоксидантного действия витамина Е.
Ослаблению связей водорода с кислородом способствуют также соседние метильные группы, экранирующие гидроксильную группу.
Витамин Е отдаёт атом водорода свободному радикалу пероксида липида (ROO•), восстанавливая его до гидропероксида (ROOH) и таким образом останавливает развитие ПОЛ (рис.5).
Взаимодействуя с перекисными радикалами, токоферолы ингибируют процессы ПОЛ, при этом образуется феноксильный радикал самого альфа-токоферола (α-ТФ-О*):
LOO* + α-ТФ-ОН LOOH + α-ТФ-О*
LOO* + α-ТФ-ОН LOH + α-ТФ-О* + H2O
Характер ингибирующего действия подтвержден экспериментально. Установлено, что в ходе реакции: 1)уменьшается количество альфа-токоферола, 2)снижается уровень RO*, 3) появляются свободнорадикальные формы альфа-токоферола.
Токофеноксильные радикалы (ά-ТФ-О* ) могут взаимодействовать между собой, образуя ковалентносвзанные димерные формы альфа-токоферола:
α-ТФ-О* + α-ТФ-О* α-ТФ-О-О-ТФ
Однако свободнорадикальные формы альфа-токоферола могут также инициировать и процессы ПОЛ. Так, было показано, что в модельной системе токофеноксильные радикалы способны индуцировать свободнорадикальное окисление ненасыщенных липидов, входящих в состав липопротеидов низкой плотности:
α-ТФ-О* + LHα-ТФ-ОН + L*
Осуществление подобной реакции в организме представляет определенную опасность, так как вызывает окислительную модификацию липопротеидов низкой плотности, в результате чего они становятся более атерогенным.
Реальная опасность подобных превращений существует, поэтому в организме действует мощная система регенерации альфа-токоферола. Основную роль в этих процессах играет аскорбиновая кислота.
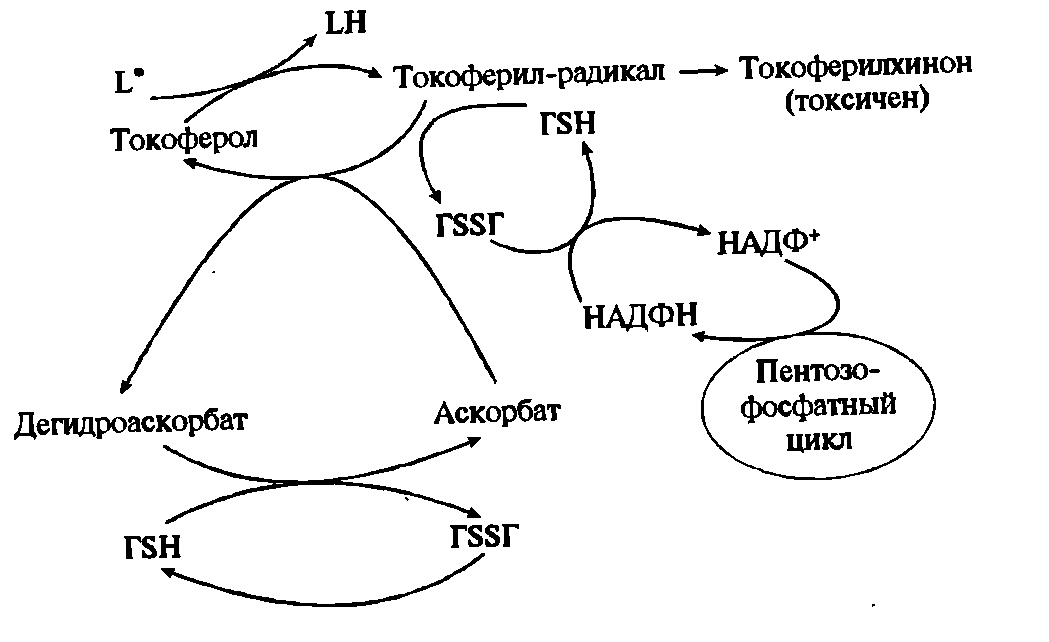
Рис.6. Восстановление радикала альфа-токоферола
Токофеноксильный радикал (α-ТФ-О*) взаимодействует с аскорбиновой кислотой (НО-АК-ОН), в результате чего радикал альфа-токоферола восстанавливается, но возникает свободный радикал полувосстановленной формы аскорбиновой кислоты – семидегидроаскорбат (НО-АК-О*), при взаимодействии которого с новой молекулой токофеноксильного радикала образуется дегидроаскорбиновая кислота (О=АК=О):
α-ТФ-О* + НО-АК-ОН α-ТФ-ОН + НО-АК-О*
α-ТФ-О* + НО-АК-О* α-ТФ-ОН + О=АК=О
Восстановление аскорбиновой кислоты и ее полувосстановленной формы - семидегидроаскорбиновой кислоты осуществляется в различных компартаментах клетки (микросомы, митохондрии, цитозоль) с участием НАДФН- и G-SH-зависимых редуктаз. Окисленный глутатион (GS – SG) быстро регенерируется под влиянием глутатионредуктазы, источником которого является пентозо-фосфатный цикл.
Представленная на схеме система регенерирующих циклов фактически исключает побочные реакции токоферилрадикала, обусловливая не только высокую антирадикальную, но и антиоксидантую активность, прерывая развитие цепей перекисного окисления липидов.
Антиокислительную активность по механизму подобному альфа-токоферольному проявляют убихиноны, стероидные гормоны, нафтохиноны и другие соединения.
Витамин С(аскорбиновая кислота) также является антиоксидантом и участвует с помощью двух различных механизмов в ингибировании ПОЛ. Во-первых, витамин С восстанавливает окисленную форму витамина Е и таким образом поддерживает необходимую концентрацию этого антиоксиданта непосредственно в мембранах клеток. Во-вторых, витамин С, будучи водорастворимым витамином и сильным восстановителем, взаимодействует с водорастворимыми активными формами кислорода -  , Н2О2, ОН• и инактивирует их.
, Н2О2, ОН• и инактивирует их.
β-Каротин, предшественник витамина А, также обладает антиоксидантантным действием и ингибирует ПОЛ.
Коэнзим Q – убихинон.
Убихиноны— это жирорастворимые коферменты, представленные преимущественно в митохондриях эукариотических клеток.
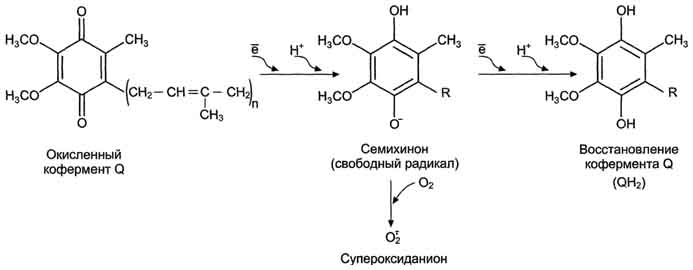
Рис.7. Строение убихинона, окисление и восстановление в процессе транспорта электронов.
Убихиноны — являются компонентами цепи переноса электронов, принимают участие в окислительном фосфорилировании и содержатся в липидной фазе митохондриальных мембран.
Максимальное содержание убихинона в органах с наибольшими энергетическими потребностями, например, в сердце и печени. Обозначение этого жирорастворимого хинона происходит от первой буквы английского названия хинона (quinone), а название убихинон отражает его широкую распространённость в природе (ubiquitous - вездесущий). Убихинон в митохондриях выполняет коллекторную функцию, присоединяя электроны от NADH-дегидрогеназы и других флавинзависимых дегидрогеназ, в частности, от сукцинат-дегидрогеназы, и участвует таким образом в синтезе АТФ.
По строению и свойствам убихинон подобен альфа-токоферолу, однако у его бензольного кольца имеются два атома кислорода, которые способны присоединять или отдавать два электрона и два протона (рис 7).
Убихинон является антиоксидантом и, в отличие от других антиоксидантов, регенерируется организмом. Кроме того, кофермент Q восстанавливает антиоксидантную активность витамина Е — α-токоферола. Антиоксидантное действие кофермента Q обусловлено, главным образом, его восстановленной формой (QH2). Активность восстановленной формы кофермента Q на три порядка выше невосстановленной. Убихинон эффективно нейтрализует супероксидный анионрадикал, гидроксильный и алкоксильные радикалы. Убихинон защищает от окисления частицы липопротеидов низкой плотности, обеспечивая восстановление липидных радикалов и регенерируя альфа-токоферол.
Реакцию нейтрализации свободных радикалов восстановленным коферментом Q (QH2) можно записать следующим образом:
LO2* + QH2 LOOH + *QH
LO* + QH2 LOH + *QH
α-ТФ-О* + QH2 α-ТФ-ОH + *QH
α-ТФ-О* + *QHα-ТФ-ОH + Q
В отличие от альфа-токоферола убихинон не является витамином, животные организмы синтезируют его в достаточных количествах. Образующиеся в процессе функционирования окисленные формы убихинона восстанавливаются аскорбиновой кислотой и различными ферментами – редуктазами с участием НАДН или НАДФН.
К природным антиоксидантам относят и растительные флавоноиды и каротиноиды, кроме этого в организме человека антиоксидантную активность проявляют и различные низкомолекулярные вещества: SH-содержащие пептиды и аминокислоты (глутатион, цистеин, метионин), мочевая кислота, аскорбиновая кислота. Некоторые гормоны (мелатонин, эстрадиол, эстриол, эстрон) также являются антиоксидантами.
Особое место в антиоксидантной защите организма занимают хелаторы ионов металлов переменной валентности, связывающие эти ионы, препятствуя тем самым проявлению их каталитического действия в образовании АФК.
Хелаторы ионов металлов переменной валентности.
Ионы металлов переменной валентности катализируют распад перекиси водорода и липоперекисей с образованием высокореакционных свободных радикалов - гидроксильного и алкоксильного:
Н2О2 + Men+НО* + НО−
ROOH + Men+ RO* + НО−
Хелатные соединения, обладающие способностью связывать ионы металлов переменной валентности (ферритин, гемосидерин, трансферрины, церулоплазмин, молочная и мочевая кислота), являются важнейшей составной антиоксидантной системы организма, так как нейтрализуют основные катализаторы свободнорадикального окисления в организме. Принято считать, что хелаторы в основном обеспечивают защиту от окисления белки крови и клеточные рецепторы. Некоторые авторы, полагают неправомерным отнесение хелаторов ионов металлов переменной валентности к антиоксидантам, так как ингибирование свободнорадикального окисления не связано с непосредственным взаимодействием со свободными радикалами с образованием малоактивных продуктов. Вероятно, более корректным является отнесение хелаторов к факторам, опосредующим антиоксидантную защиту организма.
В организме животных и человека связывание свободных ионов железа – ведущих катализаторов образования АФК и их транспорт, осуществляется, главным образом, трансферрином.
Железо, высвободившееся из трансферрина, связывается специфическим белком ферритином, который доставляет железо в митохондрии, где оно включается в состав гема с участием феррохелатазы. Запасание железа в окисленной форме препятствует его вовлечению в окислительные процессы.
Главная роль трансферрина — доставка железа из центров поглощения в двенадцатиперстной кишке и переваривания эритроцитовмакрофагами ко всем тканям. Особенно важную роль трансферрин играет в активном делении клеток, например, при кроветвороении. К трансферринам принадлежит собственно белок под названием трансферрин, а также овотрансферрин, лактоферрин, меланотрансферрин.
| <== предыдущая страница | | | следующая страница ==> |
| Перекисное окисление липидов в норме и патологии | | | Церулоплазмин (ЦП) |
Дата добавления: 2014-10-17; просмотров: 1281; Нарушение авторских прав

Мы поможем в написании ваших работ!