
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Принцип Ле Шателье
Если на систему не оказывать внешнего воздействия, то состояние равновесия будет сохраняться как угодно долго. При изменении внешних условий равновесие может быть нарушено, однако через некоторое время установится новое состояние равновесия, характеризующееся новыми равновесными концентрациями. Переход от одного состояния химического равновесия к другому называют смещением равновесия. Направление смещения определяется принципом Ле Шателье:
· если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие, то равновесие сместится в направлении реакции, уменьшающей это воздействие.
Влияние концентраций компонентов системы. При увеличении концентрации какого-либо из веществ увеличится скорость реакции, расходующей это вещество, следовательно, равновесие смещается в сторону этой реакции. При уменьшении концентрации вещества равновесие сместится в сторону реакции
образования этого вещества. Если, например, в системе
CH4(Г) + 2H2O(Г) Û CO2(Г) + 4H2(Г), 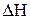 >0,
>0,
увеличить концентрацию метана CH4 или паров воды, это приведёт к смещению равновесия вправо. Если увеличить концентрацию диоксида углерода, равновесие сместится влево.
Влияние общего давления в системе. При увеличении давления равновесие смещается в сторону реакции, идущей с образованием меньшего количества газообразных веществ, при уменьшении давления - в сторону реакции, идущей с образованием большего количества газообразных веществ. Для рассматриваемой системы увеличение давления смещает равновесие влево, уменьшение давления – вправо (слева 3 моль газов, справа – 5).
Влияние температуры. При повышении температуры равновесие смещается в сторону эндотермической (DН > 0) реакции, т.е. в сторону поглощения тепла, при понижении температуры - в сторону экзотермической (DН< 0) реакции. В рассматриваемой системе нагревание приведёт к смещению равновесия вправо, охлаждение – влево (если прямая реакция эндотермическая, обратная – экзотермическая).
| <== предыдущая страница | | | следующая страница ==> |
| Выражение константы равновесия имеет вид | | | Основные понятия. Раствор – гомогенная система, состоящая из двух и более компонентов: растворитель и растворенное вещество (вещества) |
Дата добавления: 2014-02-27; просмотров: 361; Нарушение авторских прав

Мы поможем в написании ваших работ!