
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Процесс Хибинетта
Наиболее широкое распространение в промышленности получил гидрометаллургический метод разделения никеля, меди и кобальта с выделением металлического никеля электролизом. Он основан на том, что прокаленный NiO пассивируется, т.е. не растворяется в H2SO4.
Процесс состоит из следующих стадий (рисунок 17):
- окислительный обжиг файнштейна;
- выщелачивание части меди отработанным электролитом;
- восстановительная плавка оксида никеля на анодный металл;
- электролиз никеля с растворимым анодом.
На переработку по методу Хибинетта может поступать файнштейн с большим количеством железа (1 – 2%). В таком файнштейне сохраняется кобальт и его концентрирование происходит в одном продукте вместе с другими ценными компонентами.
Рисунок 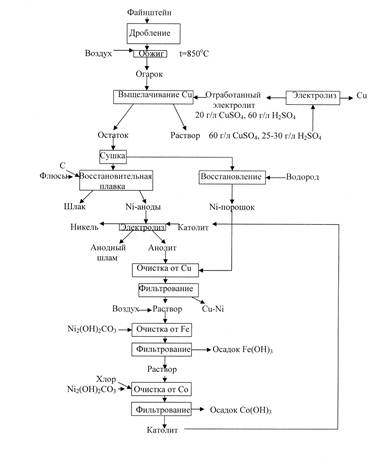
Рисунок 17. Технологическая схема процесса Хибинетта.
Файнштейн подвергают дроблению в две стадии до крупности 0,2 мм (20 меш). Затем обжигают в печах кипящего слоя, трубчатых или многоподовых. Этот обжиг заканчивается при 850°С. Из двух образовавшихся оксидов (Cu и Ni) гораздо легче растворяется в кислоте CuO, чем NiO, для растворения используют отработанный медный электролит:20 г/л CuSO4 и 60 г/л H2SO4. Однако при тепературе обжига смесь CuO и NiO выше 600°С образует по-видимому 3NiO.CuO. Поэтому вся медь, связанная в виде этого соединения, переходит в нерастворимую форму и остается в твердом остатке после выщелачивания, выщелачивается только несвязанный CuO. После выщелавания образуется электролит: 60 г/л CuSO4 и 25 – 30 г/л H2SO4, из которого электролизом с нерастворимыми анодами извлекают медь, а обогащенный кислотой раствор возвращается на выщелачивание. Остаток от выщелачивания меди, состоящий из NiO и CuO, сушат и переплавляют на металл восстановительной плавкой в электропечах. Металл отливают в аноды и направляют на электролиз никеля.
Основной трудностью электролитического рафинирования никелевых анодов является порядок выделения никеля и его примесей из растворов при электролизе. В условиях обычного электролиза в первую очередь выделяется на катоде Cu, затем H2, Fe, Co и в последнюю очередь Ni, т.е. очистки не происходит.
Для того чтобы получать чистый катодный никель, нужно проводить электролиз с диафрагмой. Электролизер разделен диафрагмой на две части, катодное и анодное пространство. Диафрагма представляет из себя раму, обтянутую с двух сторон полотном.
При прохождении электрического тока идет растворение анода, и металлы переходят в раствор, согласно их электрохимических потенциалов. Электроположительные металлы в раствор не переходят и образуют шлам, в нем содержатся: Ag, Au, платиновые металлы, которые напраляют в шламовый цех для их извлечения. Анодный раствор непрерывно отводится из электролизера на очистку от Fe, Cu и Co, а в катодное пространство вводится очищенный раствор, чтобы раствор с примесями не мог продиффундтровать через перегородку, уровень в катодном пространстве выше. Катод – чистая никелевая пластина.
Задача. Очистить анолит от Cu, Co и Fe без введения посторонних ионов, иначе осуществить циркуляцию нельзя. Поэтому Хибинетт предложил очищать электролит соединениями никеля.
Очистка от меди. Очистку от меди проводят цементацией на активном никелевом порошке, на пластине цементация не проходит, так как никель не активен.
Никелевый порошок получают восстановлением оксида никеляводяным газом. При цементации никель переходит в раствор, вытесняя медь:
Ni + CuSO4 = Cu↓ + NiSO4 (196)
избыток никеля с медью отфильтровывают; для их разделения проводят репульпацию в серной кислоте, большая часть никеля растворяется, отделенную медь направляют в медное производство.
Очистка от железа. Железо выделяют гидролитическим осаждением. Fe (II) осаждается при рН 5,5 – 6,0 вместе с Ni и Co и отделить его нельзя.
Fe (III) осаждается при рН 0,5 – 1,0, при уменьшении его концентрации рН осаждения возрастает до 4,0. Если Fe (II) окислить, то его можно осадить, оставив Co и Ni в растворе.
Процесс проводят следующим образом: через раствор продувают воздух, а для нейтрализации используют гидрокси карбонат никеля, получаемый по реакции:
2NiSO4 + 2Na2CO3 + H2O = Ni2(OH)2CO3 + 2Na2SO4 + CO2
(197)
Эту операцию проводить лучше до полного отделения меди, так как ионы меди являются катализаторами для окисления железа, и без них окисление идет медленно.
Исходя из этого, есть два варианта очистки электролита от меди и железа:
- вначале удаляют железо, затем медь;
- удаляют часть меди, потом железо, и наконец остатки меди.
Очистка от кобальта. рН осаждения Ni и Co приблизительно одинаковы, поэтому кобальт нужно окислить; у Co(OH)3 рН осаждения 4,0 – 4,5. В кислой среде окисление кобальта воздухом не идет, поэтому используют либо Cl2 с нейтрализацией гидроксокарбонатом никеля, либо гидроксид Ni (IV) – черные гидраты. Черные гидраты получают из NiSO4, NaOH и NaOCl:
NiSO4 + 2NaOH + NaOCl + H2O = NiO2.2H2O↓ + Na2SO4 + NaCl (198)
они являются сильнвми окислителями и вытесняют кобальт из раствора:
NiO2.2H2O + 2CoSO4 + 2H2O = 2Co(OH)3↓ + NiSO4 + H2SO4
(199)
Иногда Fe и Co не разделяют, а проводят совместное их осаждение Cl2 – получая совместный Fe-Co концентрат.
Однако если в никелевых растворах обнаруживают цинк, то всех этих операций недостаточно, тогда необходимо переходить на сульфатно-хлоридные растворы, в которых цинк может образовывать комплекс [ZnCl4]2- и сорбировать его на анионообменной смоле.
В процессе очистки обязательно есть потери никеля, поэтому чтобы был замкнутый цикл, ставят дополнительные ванны растворения или проводят автоклавное выщелачивание Ni3S2 с получением NiSO4, который добавляют в электролит, только в этом случае могут быть компенсированы потери никеля.
В процессе очистки получается: Ni – 99,6%; Cu < 0,1%; S – 0,01%; Fe – 0,2-0,3%.
| <== предыдущая страница | | | следующая страница ==> |
| Карбонильный метод (процесс Монда) | | | Гидрометаллургические пути переработки файнштейна |
Дата добавления: 2014-11-06; просмотров: 379; Нарушение авторских прав

Мы поможем в написании ваших работ!