
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Адиабатический процесс. Уравнение Пуассона
Адиабатическим называется процесс, происходящий в условиях тепловой изоляции системы, когда dQ = 0. Работа, совершаемая системой в адиабатическом процессе, равна взятому с противоположным знаком изменению внутренней энергии
dA = - dU.
Если адиабатический процесс проводится с идеальным газом, то
dA = - CV dT, или A12 = - CV(T2 – T1).
Найдем, как связаны между собой параметры состояния идеального газа, совершающего квазистатический адиабатический процесс. Учитывая, что dQ = 0, а dU = CV dT, уравнение первого начала термодинамики (3.3), можно переписать в виде
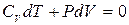 . (6.1)
. (6.1)
Пользуясь соотношением (5.4) можно выразить dT через dP и dV
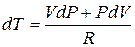
и подставить в (6.1). Принимая во внимание, что CV + R = CP получим
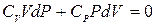 . (6.2)
. (6.2)
Введем обозначение 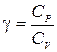 , и поделим равенство (6.2) на СV×P×V.
, и поделим равенство (6.2) на СV×P×V.
При этом произойдет разделение переменных 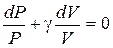 .
.
Интегрируя, получим 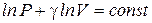 , или
, или 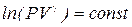 .
.
Это дает уравнение адиабаты в переменных давление-объем
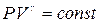 . (6.3)
. (6.3)
Соотношение (6.3) называется уравнением Пуассона.
Величина g = CP /CV называется показателем адиабаты или адиабатической постоянной. Пользуясь тем, что PV = RT, легко получить уравнение адиабаты в переменных T-V и T-P
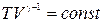 , (6.4)
, (6.4)
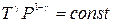 . (6.5)
. (6.5)
Так как CP > CV, то g > 1. Тогда из (6.4) следует, что при адиабатическом сжатии газ нагревается, а при адиабатическом расширении – охлаждается. Это явление используется в дизелях, где воспламенение горючей смеси осуществляется путем адиабатического сжатия. Нагревание объясняется тем, что во время сжатия внешние силы совершают над газом работу, которая идет на увеличение его внутренней энергии, а значит и температуры.
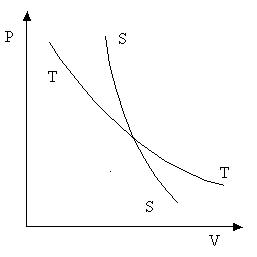 Рис. 6.1 Рис. 6.1
|
На P-V диаграмме (рис. 6.1) адиабата S-S внешне похожа на изотерму T-T, но имеет больший наклон. Сравним производные (¶P/¶V)T и (¶P/¶V)ад, определяющие наклон изотермы и адиабаты.
Из уравнения изотермы PV = const следует, что P(dV)T + V(dP)T = 0. Отсюда
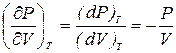 . (6.6)
. (6.6)
Беря дифференциал от обеих частей уравнения адиабаты (6.3), получим
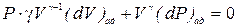 .
.
Тогда 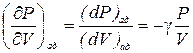 . (6.7)
. (6.7)
Следовательно 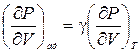 . (6.8)
. (6.8)
Так как g > 1, из соотношения (6.8) следует, что при адиабатическом изменении объема давление меняется сильнее, чем при изотермическом.
| <== предыдущая страница | | | следующая страница ==> |
| Первое начало термодинамики для идеальных газов | | | Связь модулей объемной упругости с теплоемкостями |
Дата добавления: 2014-08-09; просмотров: 1065; Нарушение авторских прав

Мы поможем в написании ваших работ!