
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ЛАБОРАТОРНАЯ РАБОТА № 4.СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
Цель работы:Ознакомление с основными закономерностями протекания гомогенных химических реакций и факторами, влияющими на скорость реакции.
Оборудование и реактивы:Na2S2O3 0,1 н, H2SO4 0,1 н, пробирки, термометр.
Теоретическая часть:
Скоростью химической реакции в гомогенной системе называется изменение концентрации вещества, вступающего в реакцию или образующегося в реакции, за единицу времени.
Скорость химических реакций зависит от концентрации реагирующих веществ, температур, а также других факторов. При постоянной температуре для простых химических реакций скорость пропорциональна произведению молярных концентраций реагирующих веществ, взятых в степенях соответствующих коэффициентам для этих веществ в уравнении химической реакции. Если уравнение реакции имеет вид
aA +bB = cC,
то для этой реакции выражение скорости определяется уравнением
v = k[A]a [B]b, (3.1)
где v – скорость реакции; a и b – стехиометрические коэффициенты в уравнении реакции; k– константа скорости, выражающая зависимость скорости химической реакции от природы реагирующих веществ и температуры; [A] и [B] – молярные концентрации веществ A и B соответственно. Это выражение получило название закон действующих масс.
Зависимость скорости реакции от температуры приблизительно может быть выражена согласно правилу Вант-Гоффа, согласно которому при увеличении температуры на каждые 10 0С скорость химической реакции возрастает в 2-4 раза. Если известна скорость химической реакции v1 при температуре t1, то скорость этой реакции v2 при температуре t2 может быть вычислена по формуле
v2 = v1γ(t2-t1)/10 (3.2),
где γ – температурный коэффициент скорости химической реакции, равный 2-4.
Правило Вант-Гоффа является приближенным и было установлено для реакций в растворах, протекающих при сравнительно низких температурах. Оно хорошо выполняется для таких реакций, которые идут с удобной для измерения скоростью, то есть не слишком быстро и не слишком медленно. Если известна скорость реакции при температуре T1 и известен температурный коэффициент, то скорость реакции при температуре T2 можно определить по уравнению: 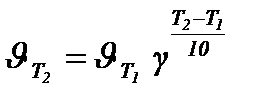
Более точную зависимость константы скорости реакции от температуры передает уравнение Аррениуса:
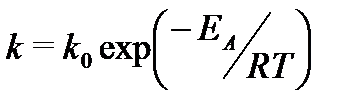
в котором EА - так называемая энергия активации, T - абсолютная температура, R - универсальная газовая постоянная (R = 8,314 Дж/(моль×K), k 0 - предэкспоненциальный множитель, мало зависящий от температуры.
Уравнение Аррениуса часто представляют в полулогарифмической форме:
lnk = lnk0 - EА/RT,
удобной для графического определения энергии активации. Энергию активации можно определить измерением константы скорости при нескольких разных температурах.
Экспериментальная часть:
Опыт 1. Качественный опыт.
Изучение зависимости скорости гомогенной реакции от концентрации реагирующих веществ проводится на примере реакции взаимодействия тиосульфата натрия и серной кислоты.
Na2S2O3 + H2SO4 = S↓ + H2SO3+ Na2SO4.
Образующаяся в реакции нерастворимая в воде сера вызывает помутнение раствора.
В пробирку прилейте 3 капли тиосульфата натрия Na2S2O3 и добавьте такое же количество серной кислоты. Наблюдайте на темном фоне помутнение раствора.
Началом реакции будем считать момент смешения растворов, условным концом реакции - выделение одного и того же количества серы. Время, необходимое для выделения данного количества серы, обратно пропорционально средней скорости реакции.
Опыт 2. Определение зависимости скорости гомогенной реакции от концентрации реагирующих веществ.
Для определения скорости реакции необходимо измерить секундомером время от момента сливания растворов тиосульфата натрия и серной кислоты до появления первых признаков выделяющейся серы (слабое помутнение раствора). Зная время протекания реакции, можно определить скорость реакции как величину, обратную времени v = 1/τ.
На стенках восьми пробирок напишите восковым карандашом номера: 1, 2, 3, 4, 1а, 2а, 3а, 4а. В первые четыре пробирки налейте из бюреток указанное в таблице количество миллилитров раствора тиосульфата натрия и воды. Таким образом, будут приготовлены четыре раствора тиосульфата натрия различной концентрации. (Результаты опыта зависят от точности отмеривания растворов!) Составьте таблицу по образцу.
Таблица 1. Влияние концентрации на скорость химической реакции.
| № пробирок | Число капель Na2S2O3 (а) | Число капель H2О (b) | Относительная концентрация Na2S2O3 a/(a+b) | Время протекания реакции, τ | Скорость реакции ·100, v = 100/ τ |
· Коэффициент пропорциональности 100 берем для удобства расчетов и построения графика.
Влейте в пробирку 1 указанное количество тиосульфата натрия и воды, затем прибавьте 4 капли серной кислоты. Перемешайте растворы, тотчас же включите секундомер. Как только заметите слабое помутнение раствора, выключите секундомер и запишите данные в таблицу.
Проделайте аналогичные опыты с остальными растворами (количество капель серной кислоты постоянно во всех опытах и равно 4 капли!). Рассчитайте скорость реакции и постройте на миллиметровой бумаге график зависимости скорости реакции (ось ординат) от концентрации раствора (ось абсцисс). График вклейте в журнал.
Какой линией выражается найденная зависимость? Должна ли эта линия проходить через начало координат?
Опыт 3. Определение зависимости скорости гомогенной реакции от температуры.
3.1.В пробирку1 налейте 5 капель раствора серной кислоты, а в пробирку 1а - 5 раствора тиосульфата натрия и 2 капли воды. Слейте содержимое пробирок 1 и 1а (не забудьте перемещать растворы!) и отметьте время по секундомеру от момента сливания растворов до появления едва заметного помутнения. Время протекания реакции при комнатной температуре запишите в таблицу 2.
Таблица 2. Зависимость скорости реакции от температуры.
| № пробирок | Температура опыта, t0C | Время по секундомеру или метроному | Скоростьреакции·100, v = 100/τ |
| Комнатная (20) | |||
В пробирку2 налейте 5 капель раствора серной кислоты, в пробирку 2а - 5 раствора тиосульфата натрия и 2 капли воды. Пробирки 2 и 2а поместите в термостат с температурой 300С (нужную температуру получают, приливая в стакан горячую воду до достижения 30 0С). После пятиминутного прогрева растворов до температуры опыта выньте пробирки 2 и 2а из термостата и быстро слейте растворы. Определите время протекания реакции при температуре 300С.
Аналогично проведите опыты с пробирками 3 и 3а при 400C.
Результаты опытов запишите в таблицу 2 и рассчитайте скорости реакции при различных температурах. На миллиметровой бумаге постройте график зависимости скорости реакции от температуры, откладывая по оси абсцисс температуру, а по оси ординат – скорость реакции. График вклейте в журнал.
Рассчитайте температурный коэффициент реакции в интервале температур 30-400C. Определите, во сколько раз увеличится скорость реакции, если температура повысится от 40 до 800C.
Памятка для построения графиков
При построении графиков на оси абсцисс откладывается независимая переменная (аргумент), а по оси ординат – зависимая (функция). Оси координат разбиваются на равные промежутки согласно выбранному масштабу. Масштаб выбирается таким образом, чтобы максимальному значению откладываемой величины соответствовал отрезок в 10 см на координатной оси. Экспериментальные точки ставятся на пересечении перпендикуляров, восстановленных из точек на координатных осях, соответствующих параметрам данного опыта. Графиком зависимости является плавная (без изломов) линия, объединяющая по возможности все экспериментальные точки.
Вопросы к защите:
1. Скорость химической реакции
2. Какова единица измерения скорости химической реакции, какова её размерность?
3. Факторы, влияющие на скорость химической реакции
4. Сформулируйте закон, отражающий влияние концентрации на скорость реакции
5. Сформулируйте правило Вант-Гоффа, при каких условиях оно выполняется.
6. Вычислите, при какой температуре реакция закончится за 5 мин., если при 20°С на это требуется 24 мин. Температурный коэффициент скорости реакции равен 3.
7. Как изменится скорость химической реакции 2А+В=С, если концентрацию одного из реагирующих веществ увеличить в три раза, а температуру смеси понизить на 300С? Температурный коэффициент равен 2.
| <== предыдущая страница | | | следующая страница ==> |
| Лабораторная работа №3. КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ | | | Лабораторная работа №5. ПРИГОТОВЛЕНИЕ РАСТВОРОВ |
Дата добавления: 2014-11-15; просмотров: 679; Нарушение авторских прав

Мы поможем в написании ваших работ!