
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Лабораторная работа №5. ПРИГОТОВЛЕНИЕ РАСТВОРОВ
Цель работы:Ознакомление с понятием "растворы" и способами выражения содержания растворенного вещества; определение концентрации раствора методом титрования.
Реактивы и оборудование:НNO3, NaOH 0,1 н., колбы мерные на 50 мл, бюретки, колбы конические на 50 мл, воронки,фенолфталеин.
Теоретическая часть:
Растворы- это гомогенные (состоящие из одной фазы) системы, содержащие несколько компонентов. Растворы бывают газообразные, жидкие и твердые. Среди соединений (компонентов), образовавших раствор, выделяют растворенные вещества и растворитель.
Растворителем принято считать компонент, агрегатное состояние которого соответствует агрегатному состоянию раствора. Как правило, это компонент, содержание которого в растворе выше содержания остальных, называемых растворенными веществами. Наибольшее практическое значение имеют жидкие растворы, в частности – водные растворы, в которых растворителем является вода.
Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества является его содержание в насыщенном растворе. Состав раствора и содержание растворенного вещества (концентрация) выражаются различными способами. Наиболее часто употребляются массовая доля, молярная и нормальная концентрация.
1. Массовая доля компонента wi- это отношение массы i-го компонента miк массе раствора Smi:
wi = mi/ Smi,
wi- безразмерная величина, принимающая значения от 0 до 1 или от 0 до 100% (в последнем случае говорят о процентной концентрации по массе).
2. Молярная доля компонента Хi- это отношение числа молей i-го компонента ni к сумме молей åniвсех компонентов, образующих раствор, безразмерная величина:
Хi= ni/ åni.
3. Моляльная концентрация растворенного вещества, или моляльность, Сm- число молей растворенного вещества n, приходящихся на 1 кг растворителя, моль/кг:
Сm= n/ ms = 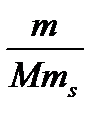 ,
,
где m–масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль);ms- масса растворителя (кг).
4. Молярная концентрация растворенного вещества, или молярность, С- число молей растворенного вещества n в 1 л раствора, моль/л, или, сокращенно, М:
С = n/ V = 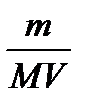 ,
,
где V- объем раствора (л); m–масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль).
5. Молярнаяконцентрация эквивалента растворенного вещества, или нормальная концентрация, или нормальность,Сэкв- число молей эквивалентов растворенного вещества nэкв в 1 л раствора, моль экв/л, или, сокращенно, н.:
Сэкв= nэкв/ V = 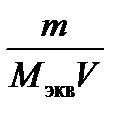 =
= 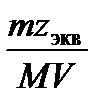 ,
,
где Мэкв – молярная масса эквивалента растворенного вещества (г/моль экв); zэкв – число эквивалентности растворенного вещества; V- объем раствора (л); m–масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль).
6. Массовая концентрация Смасс – масса растворенного вещества m в 1 л раствора, г/л:
Смасс = m/ V,
где V- объем раствора (л).
7. Титр Т – масса растворенного вещества в 1 мл раствора, г/мл.
Т=Смасс/1000
Можно применять и другие способы выражения состава раствора.
Для приготовления раствора заданной концентрации взвешивают необходимые массы (отмеряют необходимые объемы) чистых компонентов раствора.
Установление состава раствора является одной из задач аналитической химии. Количественный анализ проводят физическими, химическими и физико-химическими методами. Одним из наиболее простых среди них является титриметрия.
Титриметрия – аналитический метод, основанный на измерении объема раствора реагента точно известной концентрации, взаимодействующего с определяемым веществом. Растворы реагентов известной концентрации, используемые в титриметрии, называют титрованными (стандартными) растворами, или титрантами.
Принцип титрования: к раствору анализируемого вещества неизвестной концентрации (пробе) добавляют небольшими порциями раствор титранта до тех пор, пока не будет получен сигнал индикатора, свидетельствующий о прекращении реакции (достижении конечной точки титрования). Момент окончания титрования можно установить при помощи химической реакции или по изменению некоторого физического свойства. Часто используются органические красители, окраска которых изменяется по достижении конечной точки титрования (см. табл.).
Таблица. Области перехода окраски некоторых рН-индикаторов
| Индикатор | Окраска кислотной формы | Окраска щелочной формы | Область перехода рН |
| Фенолфталеин | Бесцветная | Красная | 8,0-10,0 |
| Лакмус | Красная | Синяя | 5,0-8,0 |
| Метилоранж | Розовая | Желтая | 3,1-4,4 |
| Метил-красный | Красная | Желтая | 4,2-6,2 |
Такие цветные индикаторы должны проявлять свойства, положенные в основу соответствующей титриметрической реакции. Индикация растворов может проводиться как визуально, так и с использованием инструментальных методов. Если проба или титрант сами по себе окрашены, специальные индикаторы могут и не потребоваться.
Расчет концентрации исследуемого раствора, в соответствии с законом эквивалентов, проводят по формуле:
Сэкв 1V1 = Сэкв 2V2,
где Сэкв 1 и Сэкв 2 – молярные концентрации эквивалента пробы и титранта, соответственно, моль экв/л; V1 – отмеренный объем пробы, л; V2 – объем титранта, израсходованный на титрование, л.
При определении концентраций кислот и оснований используют метод кислотно-основного титрования, в основе которого лежит реакция нейтрализации:
Н+ + ОН-D Н2О.
Пример 1. Какой объем 0,1 н. раствора серной кислоты необходимо отмерить для приготовления 100 мл 0,02 н. раствора?
Решение. Т.к. количество молей эквивалентов H2SO4 в исходном и приготовленном растворах одинаково, то, в соответствии с законом эквивалентов (7), объем исходного раствора V1 = 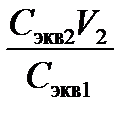 =
= 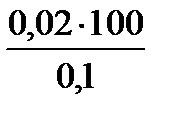 =20 мл.
=20 мл.
Пример 2. Какой объем 12%-ного раствора H2SO4 потребуется для приготовления 1 л 0,1н. раствора этой кислоты.
Решение. Масса серной кислоты в 1 л 0,1н. раствора составляет
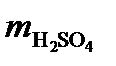 =
= 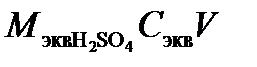 = 49×0,1×1=4,9 г. Такая масса H2SO4 содержится в 40,83 г 12%-ного раствора в соответствии с формулой (1):
= 49×0,1×1=4,9 г. Такая масса H2SO4 содержится в 40,83 г 12%-ного раствора в соответствии с формулой (1): 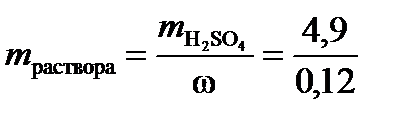 =40,83 г.
=40,83 г.
Плотность исходного раствора по данным табл.3 Приложения составляет r=1080,0 г/л. Следовательно, для приготовления 1 л 0,1н. раствора H2SO4 потребуется 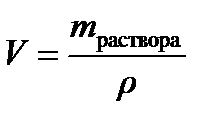 =
= 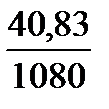 =0,0378 л или 37,8 мл 12%-ного раствора.
=0,0378 л или 37,8 мл 12%-ного раствора.
Пример 3. Плотность водного раствора NaClr= 1095,0 г/л. Определить массовую долю соли в растворе, рассчитать молярную долю NaCl, молярную концентрацию, молярную концентрацию эквивалента соли, моляльную концентрацию и массовую концентрацию раствора.
Решение. Для определения массовой доли соли в растворе используем данные табл.2 Приложения. Заданное значение плотности раствора NaCl в табл.2 отсутствует, поэтому применим метод интерполяции. Для этого используем ближайшие меньшее и большее значения плотностей и соответствующие им массовые доли раствора данной соли. Считая, что в указанных пределах зависимость между плотностью и массовой долей раствора линейная, рассчитаем массовую долю растворенного вещества w в растворе по пропорции (индекс б означает "большее", м - "меньшее"):
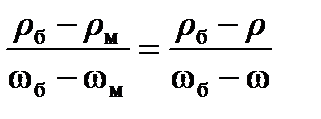 .
.
По данным табл.1 rб=1100,9 г/л; wб= 0,14; rм=1085,7 г/л; wм= 0,12. Соответственно:
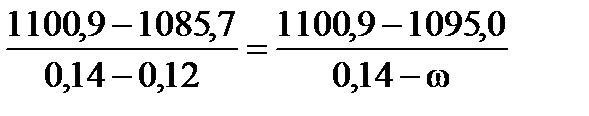 .
.
Решая уравнение, получим w=0,132 (или 13,2%).
При расчете молярной доли соли в растворе и других концентраций удобно использовать следующие соотношения: масса раствора – 100 г, следовательно, масса растворенного вещества т = 13,2г, а масса воды (растворителя) ms= 86,8 г = 0,0868 кг. В таком растворе число молей NaCl составит nNaCl = 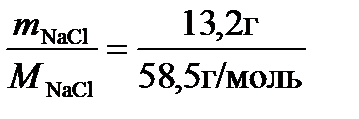 =0,2256 моль, а число молей воды
=0,2256 моль, а число молей воды 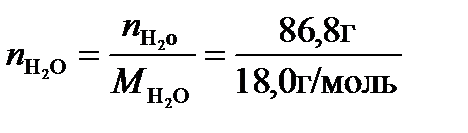 =4,8222 моль.Следовательно, молярная доля NaCl в соответствии с уравнением (2),
=4,8222 моль.Следовательно, молярная доля NaCl в соответствии с уравнением (2), 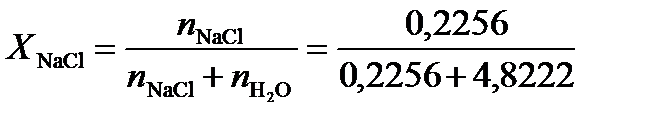 =0,045.
=0,045.
По уравнению (3) рассчитаем моляльную концентрацию: Сm= 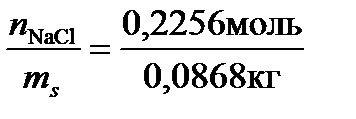 =2,6 моль/кг.
=2,6 моль/кг.
Раствор массой 100 г занимает объем V= 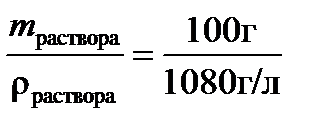 =0,0926 л, следовательно: молярная концентрация по уравнению (4): С=
=0,0926 л, следовательно: молярная концентрация по уравнению (4): С= 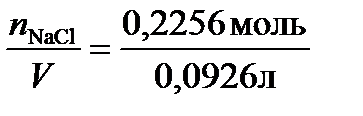 =2,48моль/л,молярная концентрация эквивалента по (5): Сэкв=
=2,48моль/л,молярная концентрация эквивалента по (5): Сэкв= 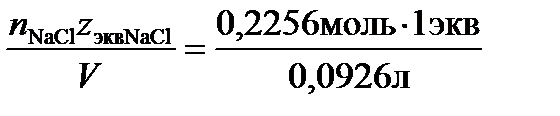 =2,48 моль экв/л,массовая концентрация по (6):Смасс =
=2,48 моль экв/л,массовая концентрация по (6):Смасс = 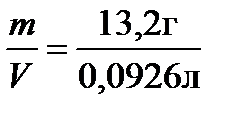 =144,54 г/л.
=144,54 г/л.
Экспериментальная часть:
Опыт 1. Приготовление раствора кислоты с заданной молярной концентрацией
1. Рассчитайте объем (мл) исходного 0,1н. раствора кислоты, необходимый для приготовления 50 мл раствора кислоты заданной преподавателем концентрации: 0,003н.; 0,004н.; 0,005н. и т.п. (см. пример 1). (расчет выполнить дома!)
2. Заполните бюретку исходным раствором до нулевой отметки. Начальный уровень исходного раствора кислоты в бюретке отметьте с точностью до 0,1 мл. (При определении уровня глаз наблюдателя и нижний край мениска жидкости должны находиться на одной горизонтальной плоскости.)
3. Перенесите рассчитанный в п.1 объем кислоты в мерную колбу, имеющую метку объема 50 мл. Для этого осторожно поверните кран бюретки или надавите на стеклянный шарик в резиновой трубочке.
4. Приливая дистиллированную воду, доведите объем раствора в колбе до 50 мл.
Определение концентрации приготовленного раствора титриметрическим методом
5. Чистую бюретку заполните титрантом0,1н. раствора NaOH с точностью до 0,1 мл. Запишите начальный уровень титрантаhн.
6. В коническую колбу отберите 10 мл приготовленного в пункте 4 раствора кислоты. Добавьте сюда же 2 капли индикатора фенолфталеина. Проведите титрование раствора кислоты, добавляя небольшими порциями раствор щелочи в колбу с кислотой. Раствор кислоты при этом непрерывно перемешивайте, держа горло колбы правой рукой. Кран (или зажим) бюретки открывайте левой рукой.
Конец титрования определите по появлению едва заметной, не исчезающей в течение 30 с, малиновой окраски фенолфталеина. (Окраску раствора удобнее наблюдать на белом фоне, поэтому подложите под колбу листок белой бумаги.)
7. Отметьте и запишите конечный уровень титранта в бюретке hк.
8. Добавьте еще одну каплю раствора щелочи. Если окраска раствора стала более заметной, значит, конечная точка титрования определена правильно.
Обработка результатов
1. По разности конечного hк и начального hн уровней жидкости в бюретке рассчитайте объем титрантаVщ, израсходованного на титрование в присутствии индикатора фенолфталеина.
2. Рассчитайте молярную концентрацию эквивалента приготовленного раствора кислоты Сэквк по формуле: Сэкв к = 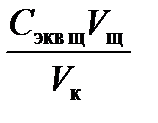 , где Vк = 100 (или 50) мл,
, где Vк = 100 (или 50) мл, 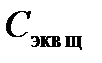 =0,1 моль экв/л
=0,1 моль экв/л
3. Сравните заданное значение концентрации раствора кислоты Сэкв,к,з и определенное методом титрования значение концентрации приготовленного раствораСэкв,к и рассчитайте суммарную погрешность титрования и приготовления раствора по формуле:
h=½ 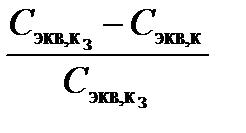 ½100%.
½100%.
4. Исходные данные, результаты измерений и расчетов занесите в таблицу.
Таблица
| Индикатор | Vк, мл | Сэкв к, з, моль экв/л | Сэкв щ, моль экв/л | hн, мл | hк мл | Vщ, мл | Сэкв,к, моль экв/л | h |
| фенолфталеин | 0,1 |
Самостоятельная работа:
Рассчитать для азотной кислоты массовую долю, молярную концентрацию, молярную концентрацию эквивалента, моляльную концентрацию и массовую концентрацию раствора данного вещества, используя значение плотности данного раствора.
Вопросы к защите:
1. Что такое раствор? растворитель? растворенное вещество?
2. Какие способы выражения состава раствора вы знаете?
3. Что такое титриметрия? В чем заключается принцип титрования?
4. Напишите выражение основной расчетной формулы определения концентрации методом титрования.
5. На каком свойстве индикаторов основано их применение?
6. В чем особенность приготовления растворов с массовой долей?
7. Как приготовить раствор с молярной концентрацией?
| <== предыдущая страница | | | следующая страница ==> |
| ЛАБОРАТОРНАЯ РАБОТА № 4.СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ | | | ЛАБОРАТОРHАЯ РАБОТА №6.Дисперсные системы. Эмульсии |
Дата добавления: 2014-11-15; просмотров: 821; Нарушение авторских прав

Мы поможем в написании ваших работ!